文献解读|Nat Genet(29):单细胞核染色质可及性分析可识别导致重度抑郁症的细胞类型和功能变异
✦ +
+
论文ID
原名:Single-nucleus chromatin accessibility profiling identifies cell types and functional variants contributing to major depression
译名:单细胞核染色质可及性分析可识别导致重度抑郁症的细胞类型和功能变异
期刊:Nature Genetics
影响因子:29
发表时间:2025.08.05
DOI号:10.1038/s41588-025-02249-4
背 景
重度抑郁症 (MDD) 是一种使人衰弱并危及生命的精神疾病,影响着全球近 5% 的人口。多种细胞类型中的各种神经生物学因素均与 MDD 有关,包括单胺能或谷氨酸能系统以及星形胶质细胞、少突胶质细胞或免疫细胞的异常。虽然取得了重大进展,但介导 MDD 风险的精确分子和细胞机制仍然未知。
实验设计
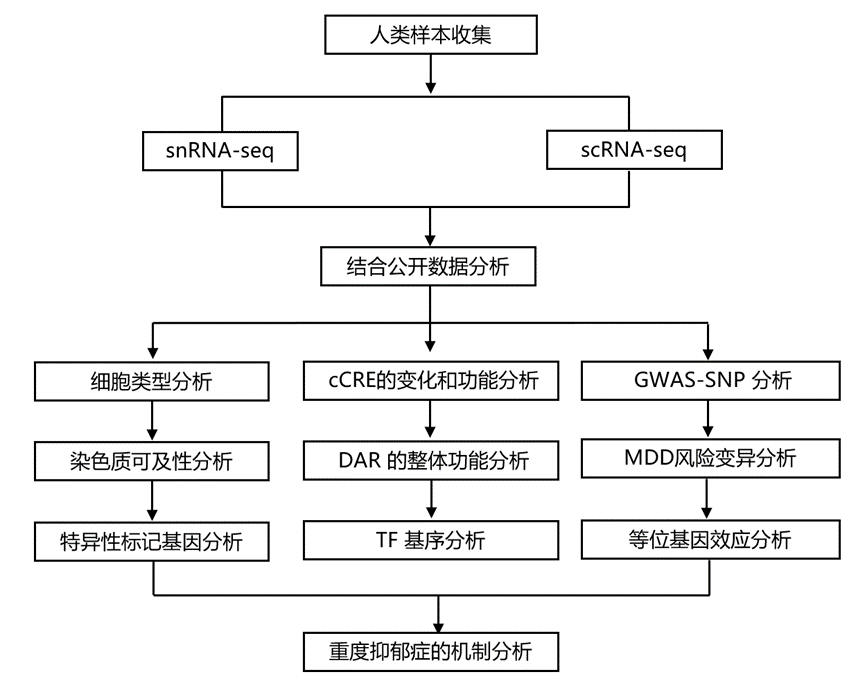
结 果
01
人类背外侧前额叶皮质(DLPFC)中的单细胞染色质可及性分析
研究团队使用来自 44 名在 MDD 发作期间死亡的个体的样本进行了单细胞核染色质可及性测序(snATAC-seq)和单细胞核转录组分析(snRNA-seq),还包括来自年龄匹配和性别匹配的神经典型个体的 40 个对照样本,揭示了 201456 个高质量细胞核,其具有总体高转录起始位点(TSS)富集得分和唯一映射的片段,来自两性的贡献相等(51%女性细胞)和条件。基于以 500 bp 分辨率测量的全基因组染色质可及性对细胞核进行无监督聚类,结果显示 7 种细胞类型[兴奋性神经元(ExN),35.2%;抑制性神经元,13.4%;星形胶质细胞,6.8%;少突胶质细胞,36.8%;少突胶质细胞前体细胞 (OPC),3.8%;小胶质细胞,2.4%;内皮细胞,1.6%)],由 38 个不同的聚类组成(图1a-b)。用于分配细胞注释的多种方法证实了 snATAC-seq 细胞类型和聚类身份(图1c-e),包括荧光激活细胞核 (FAN) 分选的细胞类型和来自前额皮质 (PFC) snATAC-seq 的特征。
这些聚类的特点是跨 239824 个独特候选顺式调控元件(cCRE)的聚类特异性可及性和聚类特异性转录因子(TF)基序可及性和结合(图1e-h)。为了鉴定基因表达的顺式调节因子,他们分析了 cCRE 可及性与基因表达(峰值到基因链接±500 kb)之间的 Pearson 相关性,鉴定出 117328 个独特的 cCRE 与 11575 个表达基因高度相关,发现了不同细胞类型之间的基因调控变异。如预期的那样,几乎所有(> 90%)基因链接的 cCRE(r > 0.45)都与转录活性染色质的皮质组蛋白标记重叠。此外,与标记 cCRE 连锁的基因在来自相同细胞类型的snRNA-seq 标记基因中显著富集,其中与每个基因相关的 cCRE 数量因峰类型而异。
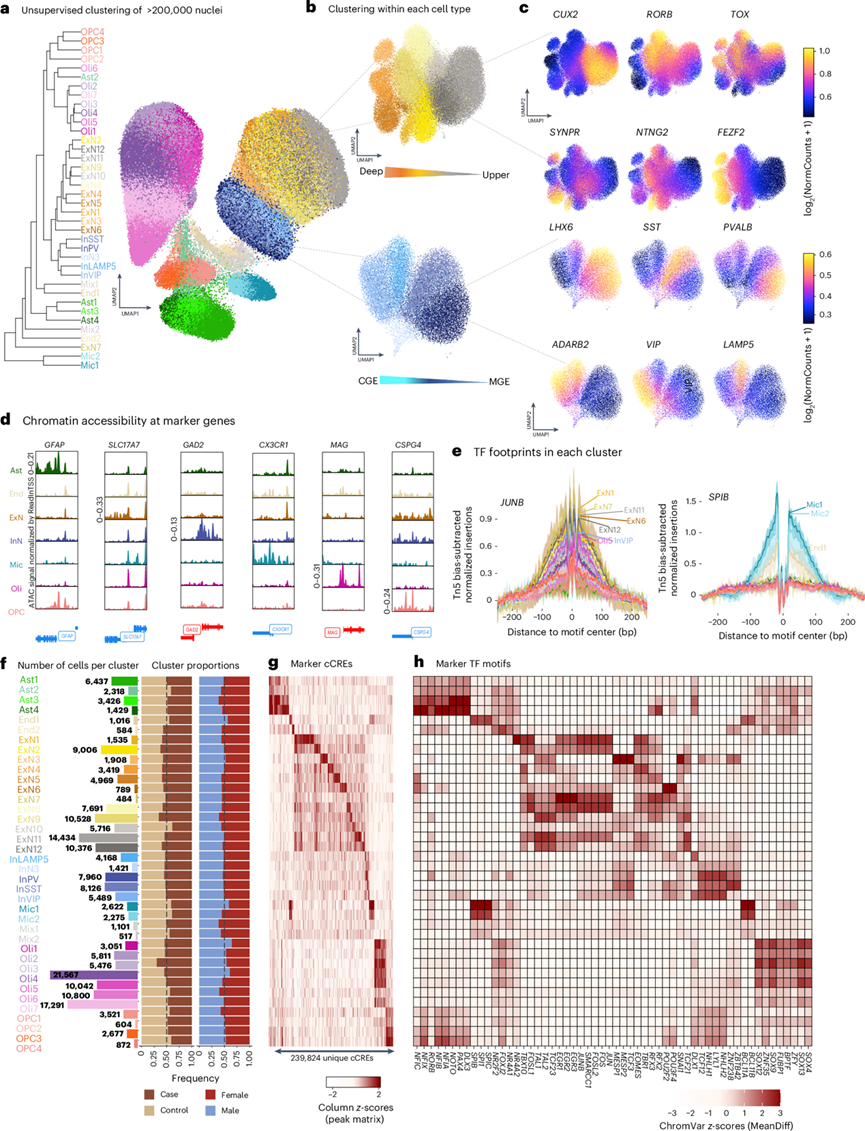
图1. 单细胞水平的染色质结构。
(a) 基于 500 bp 基因组区段测量的染色质可及性聚类的 201456 个细胞的均匀流形近似和投影 (UMAP) 图。(b) 兴奋性和抑制性细胞类型的迭代聚类揭示了 12 个兴奋性和 5 个抑制性神经元聚类。(c) UMAP 显示按皮质层特异性和中间神经元谱系标记基因的基因活性。(d) 细胞类型特异性标记基因的染色质可及性。(e) 聚类特异性标记 TF(神经元 TF,JUNB;小胶质细胞,SPIB)的 Tn5 偏差减法足迹。(f) 从左到右:每个聚类中高质量细胞核的总数,然后是 MDD 与对照组以及男性与女性受试者的细胞核比例。(g) 热图显示,与所有其他聚类相比,每个聚类中的可及性存在差异。(h) 热图显示每个聚类与所有其他聚类相比 TF 基序偏差z分数的平均差异。
02
MDD相关的染色质可及性
他们使用每个受试者的可及性估计值研究了聚类和细胞类型内的 MDD 关联可及性。在 38 个已表征的聚类中,有 25 个聚类与总共 4751 个 MDD 关联的差异可及性区域(以下称为 DAR)相关(图2a)。 为了了解 DAR 的整体功能影响,他们利用峰到基因关联 ( r > 0.45)确定了最有可能受到影响的基因 ,并研究了它们的已知功能。在这些基因中,发现抑郁症的精神疾病关联性最高,其中 80% 的关联在 PsyGeNET22 中显示出一致的证据,64% 的关联在精神分裂症中显示出一致的证据。此外,聚类特异性 DAR 连锁基因在来自同一受试者14的 MDD 相关差异表达基因 (DEG) 中显著富集(图2b),富集水平因 DAR 峰类型而异。ExN1 中与内含子 DAR 连锁的基因在整体上调的 DEG 中高度富集,而 Mic2 中的启动子 DAR 与 MDD 中的下调基因显著相关。类似地,与 ExN1 DAR 相关的基因的匹配聚类中的基于基因表达的模块得分增加,显示出在 MDD 中的可及性特别增加,而他们观察到与下调的 Mic2 DAR 相关的表达下降的趋势。
总体而言,大多数 DAR在 MDD 中可及性降低,主要存在于小胶质细胞 Mic2(58.5%)和深层 ExN1(21.2%)聚类中(图2c)。这些聚类中的细胞数量与所有其他聚类相当,并显示出潜在混杂因素的均匀贡献(图1f)。
近端和远端基因调控的细胞类型作用先前已有报道。例如,神经元中的活动依赖性调控涉及许多增强子元件,而启动子调节小胶质细胞活化的物种特异性差异。在 MDD 中大多数不易接近的 DAR (97%) 主要与皮质染色质免疫沉淀测序(ChIP-seq)公开数据中的组蛋白标记相吻合,这些标记通常存在于活性基因启动子中(图2c),这由 H3K4me3 + H3K27ac + (74%) 定义,其中 86% 是 Mic2 DAR),而不是增强子(H3K27ac+,23%)。此外,聚类特异性DAR在先前鉴定的MDD相关组蛋白修饰峰、染色质状态或差异甲基化区域中存在差异富集,这表明染色质可及性与MDD中的其他表观遗传机制之间存在潜在的细胞类型特异性相互作用。
为了总结可能受MDD相关染色质重塑影响的生物学途径,他们检测了聚类特异性DAR关联的基因本体(图2d)。ExN1 DAR与参与神经递质释放和突触过程的基因相关,而Mic2 DAR与与免疫信号传导和TF结合活性相关的基因相关。
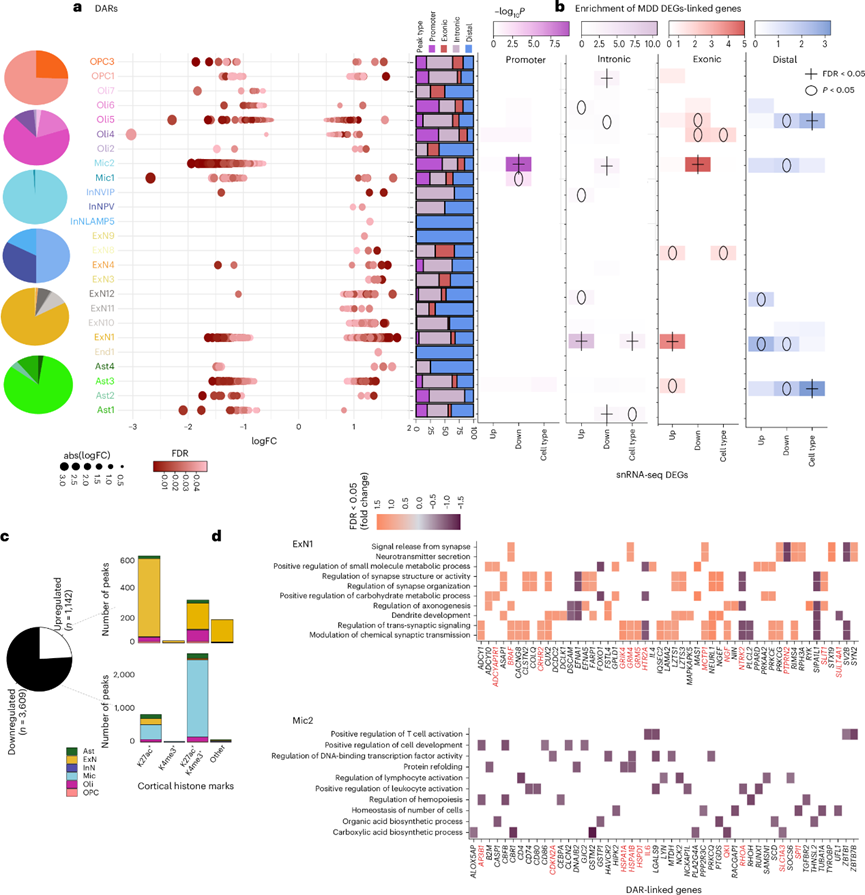
图2. MDD 患者的染色质分析。
(a) 饼图显示了 MDD与神经典型对照中的聚类特异性 DAR以及每种细胞类型每个聚类中 DAR 的分布。(b) 热图显示了 与 MDD 相关的上调或下调 DEG。(c) 饼图显示了在所有聚类中汇总的 MDD 与对照相比差异较大或较难接近的 DAR 总数 。(d)通路富集分析。
03
MDD相关染色质中TF结合位点的表达过高
TF结合可以调节染色质的可及性并介导基因表达27。为了了解TF结合与转录变化之间的相互作用,他们使用Homer技术鉴定了每个聚类中上调或下调的DAR中富集的TF结合基序(图3a)。为了证实这些观察结果,他们使用ChromVar技术评估了每个聚类中MDD细胞与对照细胞之间GC和可及性偏差校正的TF基序偏差z得分(图3c)。
ExN1 DAR 中高度富集的 TF 结合基序属于碱性亮氨酸拉链 (bZIP)、碱性螺旋-环-螺旋 (bHLH) 和螺旋-转角-螺旋家族(图3a),已知它们调节活动依赖性和神经发育相关功能。另一方面,在 Mic2 DAR 中富集的 TF 基序大多是典型的小胶质细胞因子,包括 ETS 结构域和干扰素调节因子 (IRF),它们是先驱的和谱系特异性的 TF(例如,PU.1、IRF),可以调节染色质的可及性、小胶质细胞稳态和免疫激活。
他们推断,在MDD中,与转录因子基序(TF motif)相符的染色质可及性降低会导致TF结合力整体下降,进而降低靶基因的表达,反之亦然。为了验证这一假设,他们确定了一组结合力最有可能受MDD相关可及性影响的TF,并编制了它们最可能的靶基因列表,然后在snRNA-seq中检验这些基因的表达是否与MDD相关。为了优先筛选MDD中的TF,他们选择了在ExN1和Mic2 DAR中基序高度富集且在同一细胞中也高表达的TF(图3b)。在这些TF中,他们进一步将选择范围限制在MDD细胞与对照细胞中结合位点可及性差异最大的TF(图3c)。为了研究MDD与优先TF靶基因之间的关联(图3c-d),将它们与上调或下调的DEG以及MDD相关的全基因组或全转录组基因重叠(图3e)。此外,他们生成了聚类特异性的TF靶基因调控网络图谱。在这些网络中,绿色节点代表包含与其假定靶基因相连的TF结合位点的非编码DAR,根据DEG或MDD相关基因的状态进行着色(图3f-g)。最后,对于每个转录因子 (TF),在匹配的 snRNA-seq 聚类中比较了 MDD 组和对照组之间的靶基因表达模块得分(图3h-i)。总体而言,这些结果证实了他们的假设,即 MDD 中 TF 结合位点可及性降低与靶基因表达降低相关,反之亦然。
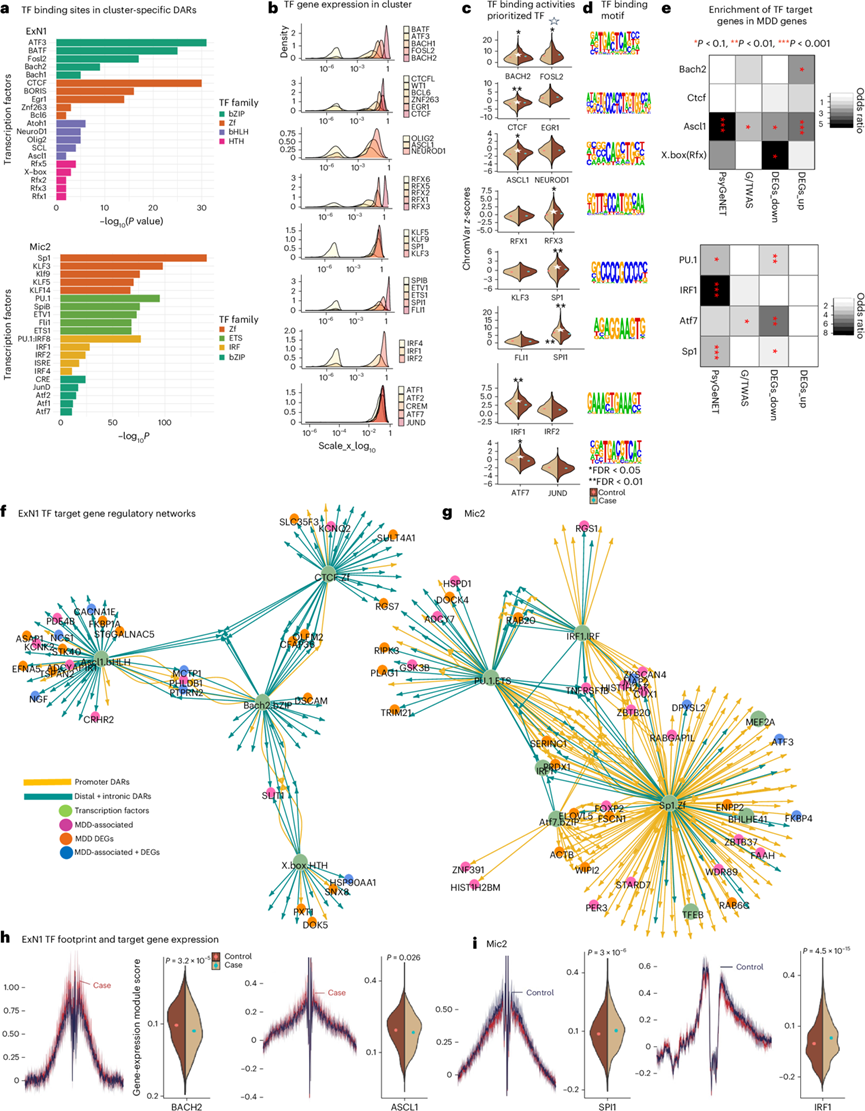
图3. TF 在 MDD 中的作用。
(a) 条形图显示在ExN1和Mic2 DAR中显著富集。(b) 密度图显示了ExN1和Mic2细胞中富集TF的snRNA-seq整合基因表达。(c) MDD 与对照细胞的 GC 含量和可及性偏差校正的 TF 基序偏差 z 分数。(d) 优先考虑的 TF 基序的 DNA 序列标识(Homer)。(e) MDD 相关的优先 TF 靶基因与MDD相关基因组分析。(f-g) ExN1和 Mic2中 MDD 相关优先 TF 的基因调控网络。(h-i) 基因表达分析。
04
细胞型染色质中MDD的遗传力
为了优先考虑可能介导 MDD 遗传风险的细胞类型聚类,他们使用分层连锁不平衡评分回归分析了聚类特异性染色质内全基因组关联研究 (GWAS) 的单核苷酸多态性 (SNP)遗传力富集。在此过程中,他们使用了 MDD 及相关精神表型和非脑相关控制性状的 GWAS 汇总统计数据。已知与 MDD 遗传相关的精神疾病和性状的遗传风险在 ExN1 和 ExN2 聚类的标记 cCRE 中显著富集(图4a)。与 ExN1 类似,ExN2 与 L5/6 端脑内神经元最为相似。事实上,根据 MDD GWAS 汇总统计数据分析出的富集度在 ExN1 聚类中一致最高(图4a)。他们还分析了每个聚类(候选 DAR)中与 MDD 相关的染色质区域的遗传力富集度,结果显示,ExN1 中 MDD和失眠的富集度同样最高。
为了确认这些富集是否由连锁不平衡 (LD) 驱动,他们使用汇总统计数据 (HESS) 的遗传力估计量,估计了由 1000 人基因组欧洲人口定义的 LD 区段中 MDD 相关遗传变异的遗传力。这导致约 5%的 LD 区段显著富集了 MDD 相关变异。然后,他们分析了与任何 LD 区段中随机抽样的 cCRE 相比,MDD 相关的 LD 区段是否在每个聚类中包含候选 DAR 的过度表示。与之前的观察结果一致,在 ExN1 中观察到了最显著的富集(图4c)。此外,ExN1 候选 DAR 连锁基因(r > 0.45)显著富集基因组和转录组范围的 MDD 风险基因(图4d)。
为了识别 ExN1 中可能与 MDD 遗传风险相关的 TF 结合位点,他们使用 Homer 分析了在 ExN1 特异性 cCRE 中富集的 TF 基序,这些基序专门位于 MDD 显著可遗传的 LD 区段内(HESS), 并与 GC 匹配的背景峰进行了比较。在 ExN1 标记和差异染色质中均显著富集的 TF 与活动依赖性功能(bZIP、Zf)、神经发育(bHLH)相关,并且包括先前与 MDD 遗传性相关的TF(例如Egr1、Neurod1)(图4e)。
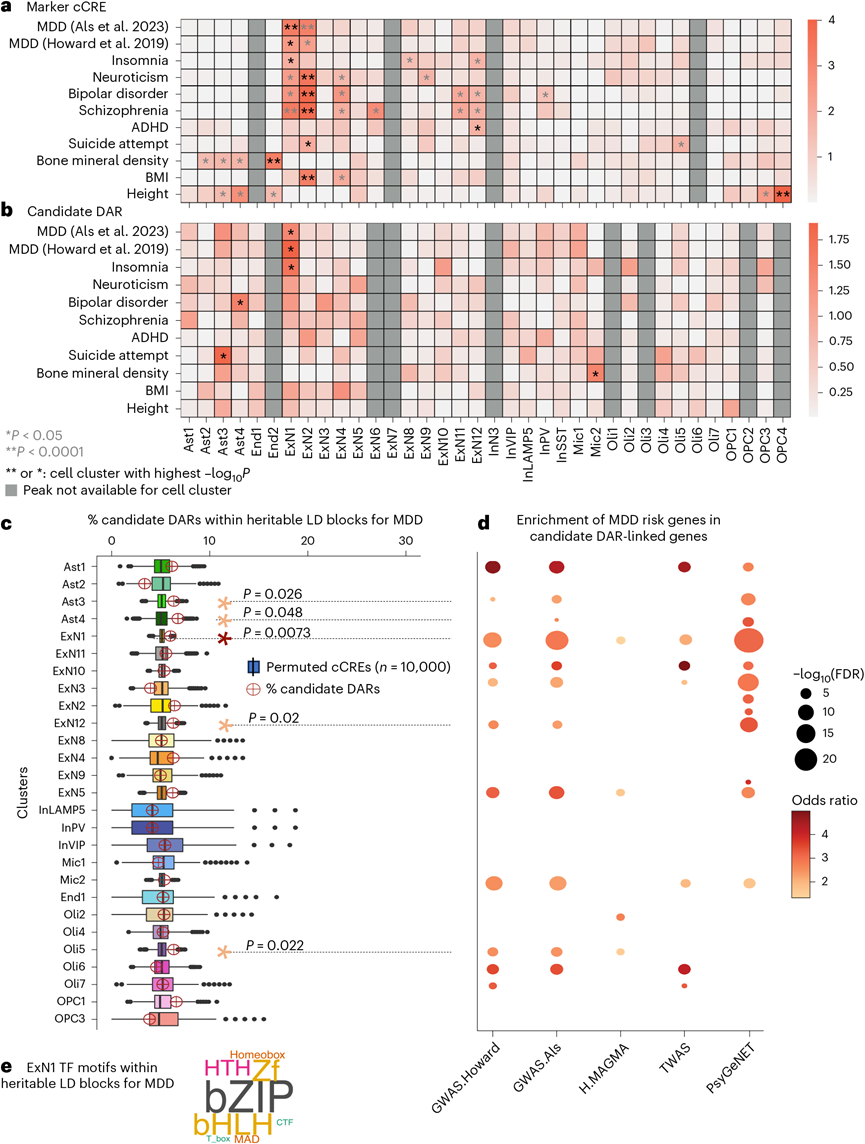
图4. 与细胞特异性和 MDD 特异性染色质结构的遗传重叠。
(a-b) 使用聚类特异性标记 cCRE和聚类特异性候选 DAR,热图显示属于每个聚类中每种性状的 GWAS SNP 的 LDSC 富集。(c) 在 MDD 中显著可遗传的 LD 区段内,聚类特异性候选 DAR 的过度表示。(d) 点图显示与聚类特异性候选 DAR 相关的基因与MDD 相关基因。(e) TF 基序家族在 ExN1 特异性标记 cCRE 和候选 DAR 中富集。
05
MDD风险变异的聚类特异性和等位基因特异性效应
为了了解每个聚类中 MDD 相关遗传变异的功能影响,他们评估了 GWAS中发现的 MDD 相关 SNP、与它们具有高 LD 的 SNP(r2 ≥ 0.8)以及通过全基因组精细图谱发现的 SNP 的等位基因特异性效应。重点关注具有潜在调控作用的 MDD 相关 SNP,方法是将它们与细胞类型和聚类特异性标记 cCRE 以及 MDD 相关的候选 DAR[称为候选 SNP(cdSNP)]重叠(图5a)。正如预期的那样,与 MDD 相关的 GWAS SNP 相比,cdSNP 在 DLPFC 剪接数量性状基因座 (sQTL) 和表达数量性状基因座 (eQTL) 中表现出显著富集。
为了检验 cdSNP 对聚类特异性染色质可及性的等位基因效应,他们分析了三个互补的变异效应得分:deltaSVM、GkmExplain和基于 gkm-SVM 分类器的计算机模拟诱变。这些模型经过训练可以区分每个聚类中的开放染色质区域 (OCR) 与 GC 匹配的背景序列。总的来说,他们鉴定出 97 个具有统计学意义的非编码 cdSNP[以下称为显著 SNP(sSNP)](图5a),这些位点在所有三个 gkm-SVM 模型中均显示出显著的变异效应得分。几乎所有 MDD sSNP(97.9%)都在特定细胞类型的聚类之间共有。通过识别表达与含 sSNP 的 cCRE(峰到基因连锁)可及性之间相关性最高的基因,确定了基因变异的推测性长程基因调控效应。与最近的基因类似,与 sSNP 关联的基因主要与抑郁症状和幸福感测量相关,并与突触组织和通讯相关的通路相关。
为评估重度抑郁症(MDD)相关sSNP对染色质可及性和基因表达的调控影响,他们将分型基因型与snATAC-seq及snRNA-seq数据整合,并采用WASP校正映射偏差。随后使用WASP中的β-二项混合单倍型检验(CHT)检测每个sSNP在读数中的等位基因差异,同时校正GC含量和个体总测序深度。总体而言,27.4%的sSNP在500bp cCRE区域内显示snATAC-seq可及性的等位基因失衡(图6a);19.7%的sSNP(ExN1神经元中22.7%)在考虑sSNP±500kb内外显子时显示snRNA-seq基因表达的等位基因差异。其中包括具有最高GkmExplain变异效应评分的ExN1中MDD sSNP(rs12694917;图5b)和MDD62先导SNP(rs2276138)(图5c),这些在WASP和SALSA69中均显著(图6a)。此外,为预测兴奋性神经元中MDD sSNP的基因调控效应,他们改良了既往报道的混合效应逻辑回归模型。具体而言,基于同一细胞中潜在靶基因(峰值-基因连锁,±500kb,r >0.1)的snRNA-seq整合基因表达变化(升高或降低),预测cCRE中MDD sSNP替代等位基因的单细胞可及性(0/1),同时控制个体内变异。在ExN1中显示显著可及性或表达等位基因失衡的MDD sSNP也与靶基因表达的显著等位基因效应相关(图6b)。
最后,他们通过体外荧光素酶实验直接验证了最具显著性的MDD sSNP的等位基因影响,这些sSNP预计会破坏ExN1(n =4)和Mic2(n =1)中的转录因子结合位点。所有测试的sSNP(5/5),包括先前关注的ExN1(rs2276138、rs11601579)(图5c-d)和Mic2(rs10210757),均显示报告基因表达的显著等位基因差异(图6c)。值得注意的是,仅在内源性表达相应sSNP预测破坏的转录因子的细胞系[HEK293或BE(2)C]中,报告基因表达的等位基因效应才显著(图6c),这强调了所鉴定转录因子在调控MDD风险变异等位基因特异性表达中的重要作用。
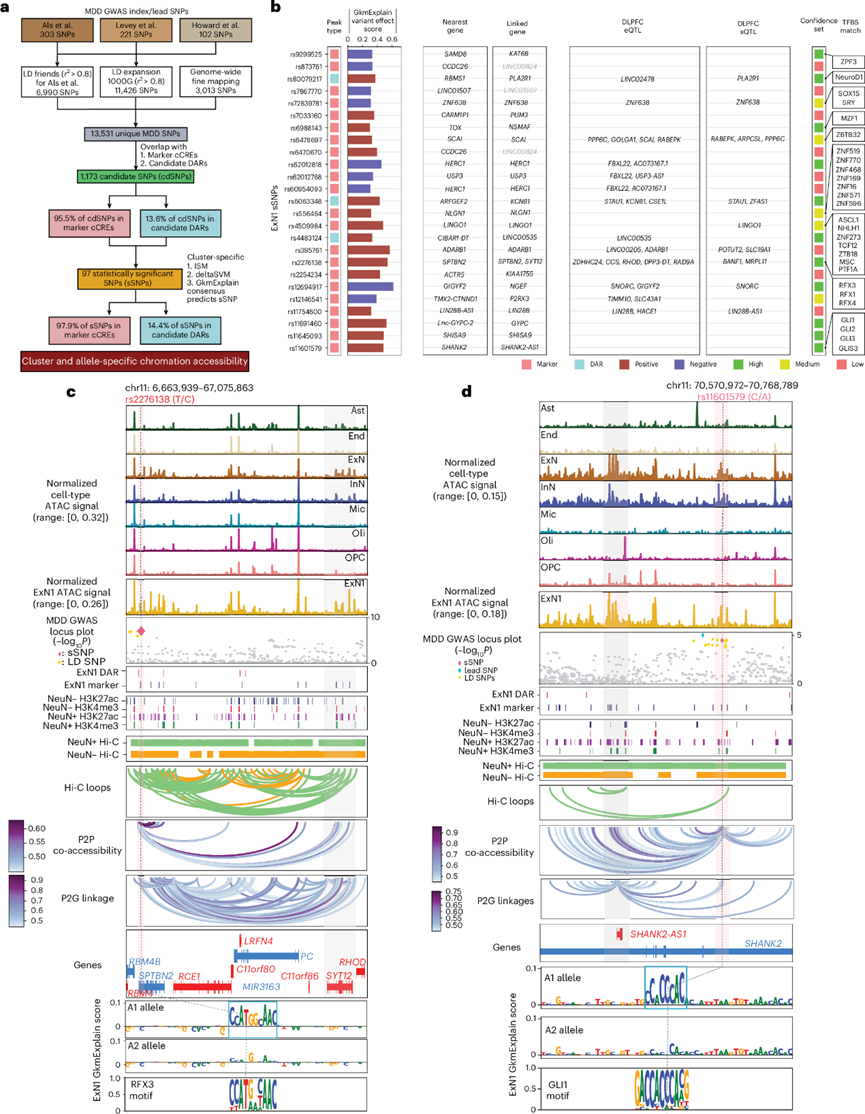
图5. MDD 相关遗传变异的等位基因效应。
(a) 用于识别与 MDD 相关的 sSNP 的流程图,显示了在三个 gkm-SVM 模型中对染色质可及性的等位基因特异性和聚类特异性影响。(b) 在 ExN1 聚类中对染色质可及性具有显著等位基因影响的 MDD sSNP。(c) ExN1 sSNP (rs2276138) 的多模态可视化。(d) ExN1 sSNP (rs11601579)的多模态可视化。
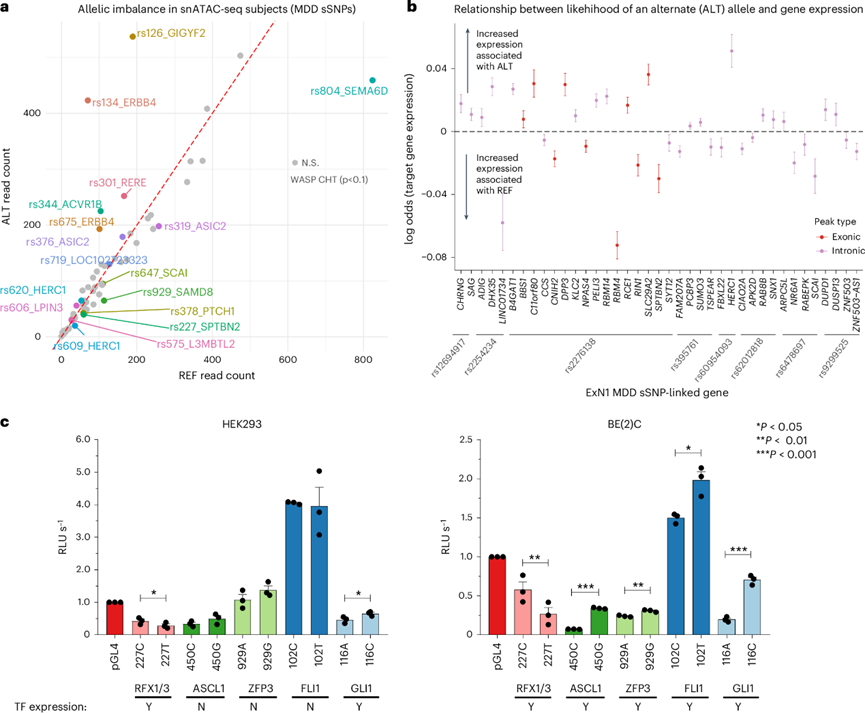
图6. MDD 风险变异的等位基因特异性调控影响。
(a) 点图显示了 WASP 校正的跨受试者 MDD sSNP 参考等位基因与替代等位基因的 snATAC-seq 读取计数。(b) 基于兴奋性神经元中链接基因的表达预测 cCRE中 sSNP 的替代等位基因的存在 。(c) 预测会显著破坏 ExN1和 Mic2中 TF 结合位点的 MDD sSNP 。
+ + + + + + + + + + +
结 论
本研究结合单细胞染色质可及性与 84 名个体背外侧前额叶皮质中超过 20 万个细胞的基因表达,研究了与神经正常对照者相比,MDD 背后的基因调控机制。MDD 相关的染色质可及性改变在深层兴奋性神经元中尤为显著,这些神经元的特征是TF基序的可及性和 NR4A2的结合。这些神经元富含 MDD 相关的基因变异,从而破坏了与可能影响突触通讯的基因相关的 TF 结合位点。此外,在 MDD 个体中,灰质小胶质细胞聚类在已知调节免疫稳态的 TF 结合位点的可及性降低。最后,本研究利用基于序列的可及性预测、供体特异性基因型和基于细胞的分析方法,确定了 MDD 风险变异的基因调控效应。这些发现揭示了基因变异可能增加 MDD 风险的细胞类型和调节机制。
+ + + + +



 English
English


