文献解读|Cell(45.5):比较蛋白质组学阐明人类胚胎植入前发育和失败
✦ +
+
论文ID
原名:Comparative proteomic landscapes elucidate human preimplantation development and failure
译名:比较蛋白质组学阐明人类胚胎植入前发育和失败
期刊:Cell
影响因子:45.5
发表时间:2025.01.17
DOI号:10.1016/j.cell.2024.12.028
背 景
哺乳动物的植入前发育包含两个连续的细胞命运转变。第一个转变涉及将高度分化的生殖细胞(精子和卵子)重新编程为全能状态。该过程称为卵母细胞到胚胎的转变 (OET),需要消除生殖细胞特异性的表观遗传标记并建立发育基态。后续转变发生在桑葚胚(Mor)到囊胚 (Blast) 的转变期间,其中细胞要么进入滋养外胚层 (TE) 谱系,要么进入多能内细胞团 (ICM)。这种选择也称为第一个细胞命运特化,对于建立不同的细胞谱系至关重要,其中 TE 有助于胎盘的形成,而 ICM 最终会形成胎儿。合子基因组激活 (ZGA) 或胚胎基因组激活 (EGA) 标志着受精后的第一个转录事件并连接了上述两个细胞命运转变。ZGA 分为两波:小波和大波。在小鼠中,小波 ZGA 发生在受精后几小时,而大波发生在晚期 2-细胞 (L2C) 阶段。在人类中,小波 ZGA 发生在晚期 1-细胞阶段 (L1C),而大波则出现在 8 细胞 (8C) 阶段左右。ZGA如何有助于谱系特征化仍然未知。除此之外,植入前发育与人类不孕不育有关,这是一个日益严重的全球健康问题。虽然辅助生殖医学取得了进步,但仍有相当数量的卵母细胞未能达到 8C 阶段,归类为劣质 (PQ) 胚胎。目前对PQ 胚胎形成机制的理解很大程度上是有限的。因此,全面了解植入前发育(特别是人类的发育),对于解决这些基本问题和临床挑战至关重要。
实验设计
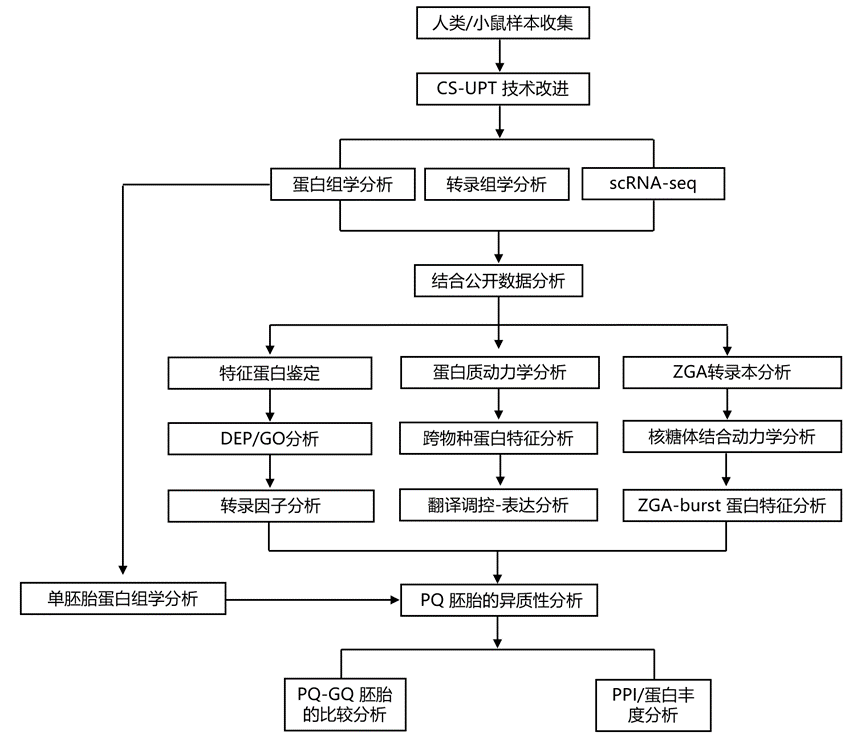
结 果
01
人类卵母细胞和胚胎的 CS-UPT 改进
研究团队开发了一种超灵敏蛋白质组学技术 (CS-UPT) 的综合解决方案,以实现小鼠的单细胞和低输入蛋白质组学分析。他们收集了人类中期I(MI)卵母细胞和胚胎样本对原始CS-UPT方法进行测试。。所有重复中生成的蛋白质组学谱显示出高覆盖率和可重复性(图 S1 A-B)。在单个卵母细胞和胚胎中分别检测到平均 3846 和 3670 个蛋白质组分 (PG)(图 S1 C)。蛋白质组学数据通过已发表的人类卵母细胞或早期胚胎翻译组进行了验证。例如,与 MI 卵母细胞相比,8C 胚胎中已知的母体蛋白合子停滞 1 (ZAR1) 的蛋白质水平降低,这与它的翻译降低一致(图 S1 D)。在 8C胚胎中检测到了8C 特异性标记 H3.Y,但在 MI 卵母细胞中未检测到(图 S1 E)。主成分分析(PCA)揭示了两个阶段之间不同的蛋白质组学谱(图 S1 F)。因此,鉴定出 683 种差异表达蛋白质(DEP)(图 S1 G)。GO分析表明,与生物过程相关的蛋白质(包括翻译起始和 RNA 分解代谢过程)在 MI 卵母细胞中富集,而细胞周期 G2/M 期转变和核运输中的蛋白质在 8C 胚胎中发生激活(图 S1 H)。例如,真核翻译起始因子 4E 家族成员 1B(EIF4E1B)可识别用于蛋白质合成的 mRNA 5′ 帽结构,在 MI 卵母细胞中富集(图 S1 I)。最近的报告表明, eIF4E1B 介导的母体 mRNA 选择性翻译对小鼠的 OET 至关重要,此后其蛋白质水平降低。受这些结果的鼓舞,他们改进了 CS-UPT(称为 CS-UPT2),方法为(1)将裂解缓冲液中的去垢剂十二烷基硫酸钠 (SDS) 换成n-十二烷基-β-D-麦芽糖苷 (DDM),(2) 简化工作流程,无需引入磁珠和转移样品,(3) 构建更深的谱库,(4) 升级数据库搜索软件。两种方法均表现出相似的可重复性(图 S1 J),但 PG 数量增加了 20% 以上(图 S1 K)。更重要的是,肽前体增加了一倍,每个 PG 的前体数量增加了 70% 以上(图 S1 L)。他们将单个人类卵母细胞蛋白质组学数据与最近的 SCP 研究的数据进行了比较,发现CS-UPT2 表现出更好的性能(图 S1M-N)。随后,他们确定了进行深入蛋白质组分析需要多少个胚胎。随着使用的胚胎增加,可重复性和检测深度也相应提高(图 S1O-Q)。考虑到资源有限,他们每个样本使用五个卵母细胞或胚胎进行进一步分析。
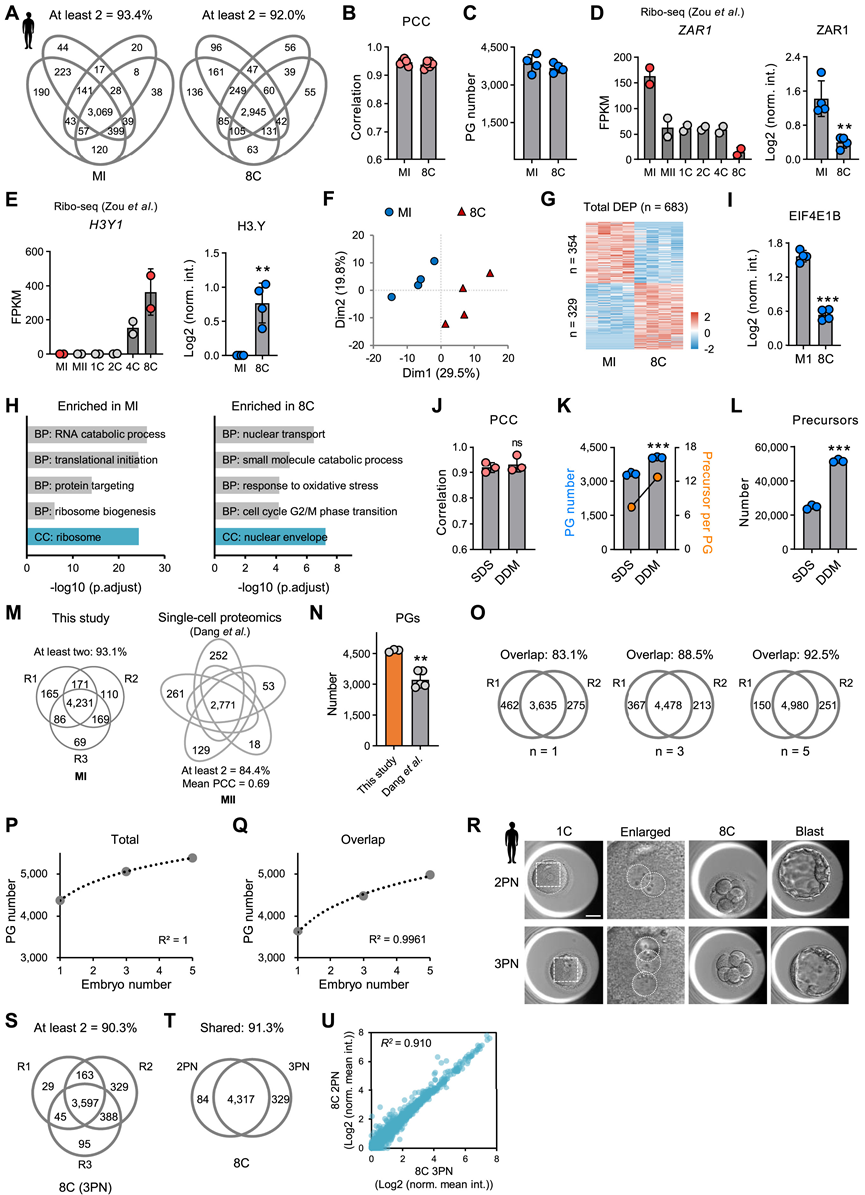
图S1. 人类蛋白质组学数据验证。
(A) 维恩图显示四个生物学重复中 CS-UPT 鉴定蛋白质的重叠。(B) 四个生物学重复中每对重复之间的皮尔逊相关系数(PCC)值。(C)每个样本中检测到的 PG 数量。(D-E) ZAR1和H3.Y的翻译水平和蛋白水平。(F) 人类 MI 卵母细胞和 8C 胚胎的蛋白质组学数据的 PCA。(G) 热图显示两个阶段中的差异表达蛋白质 (DEP) 。(H)GO分析。(I) 两个阶段中 EIF4E1B 的蛋白质水平。(J) 四个生物学重复中每对重复之间的 PCC 值。(K-L) 两种方法检测到的 PG 和蛋白质前体的数量。(M) 维恩图显示CS-UPT2鉴定的蛋白和在单卵细胞水平上从参考数据中鉴定的蛋白之间的重叠。(N) 两项研究中检测到的 PG 数量。(O) 维恩图显示两个具有不同测试胚胎数量的生物重复之间已鉴定蛋白质的重叠。(P-Q) 从不同数量的人类胚胎中鉴定出的总蛋白质和重叠蛋白质的数量。(R) 2PN 和 3PN 胚胎在植入前发育过程中的代表性照片。(S-T) 维恩图显示 3PN 胚胎中三个生物重复之间已鉴定蛋白质的重叠以及 2PN 和 3PN 胚胎之间已鉴定蛋白质的重叠。(U) 散点图比较 2PN 和 3PN 胚胎的蛋白质组学概况。
应用 CS-UPT2 获取人类 MI 卵母细胞和植入前胚胎的蛋白质组学谱,包括单细胞 (1C)、四细胞 (4C)、8C、Mor 和 Blast。由于伦理限制,未包括中期 II (MII) 卵母细胞,1C 和 4C 阶段使用三原核 (3PN) 胚胎(图 1 A)。值得注意的是,由额外精子进入而形成的 3PN 胚胎可以经历植入前发育(图S1 R)。他们比较了 8C阶段的 3PN 胚胎和 2PN 胚胎的蛋白质组,发现它们相似(图 S1S-U)。为了进行比较分析,他们对小鼠卵母细胞和早期胚胎进行了蛋白质组学分析,包括 MII 卵母细胞、L1C、L2C、4C、8C、Mor 和 Blast 胚胎(图 1 A)。两个物种的蛋白质组学数据在三个重复中显示出高覆盖率和可重复性。总的来说,在人类和小鼠中分别鉴定出 7832 和 6323 个 PG(图 1 B)。在一个和多个发育阶段的至少两个重复中检测到的 PG 中,它们由人类的 7709 个基因和小鼠的 6256 个基因编码。除了 8C 特异性 TPRX1 之外,数据中还检测到了对 ZGA 和谱系特化至关重要的转录因子 (TF),例如 ZSCAN4、DUXA、KLF17、POU5F1、CTCF、KLF4 和 CDX2(图 S2 E),而在 SCP 研究中却没有检测到。与之前对小鼠进行的蛋白质组学研究相比,数据集由每个样本 20 个胚胎生成,所包含的蛋白质数量几乎是之前使用每个样本 8000 个胚胎的研究的两倍。
在 PCA 图中,人类和小鼠胚胎的蛋白质组学谱均显示出相似的发育趋势(图 1 C),他们在两个物种中都鉴定出了 5028 种保守蛋白质(图 1 D)。GO 细胞成分(CC)富集分析显示,两个物种在不同阶段的蛋白质亚细胞分布相似(图 1 E)。同源 TF 通常表现出阶段特异性的动态(图 1 F)。例如,CDX2 是一种参与第一次谱系指定的保守 TF,它在两个物种的 Blast 阶段均富集(图 1 G)。然而,STAT3 在物种之间显示出相反的动态(图 1 G)。此外,人类特异性 TPRX1 在 8C 阶段表现出富集。在小鼠中,Cdip1(细胞死亡诱导 p53 靶标 1)是一种研究相对较少的 TF,它在 ZGA 周围显示出与 TPRX1 类似的动态(图 1 G)。

图1. 人类和小鼠植入前发育的蛋白质组学图谱。
(A) 用于 MS 及其配对发育事件的人类和小鼠卵母细胞和胚胎阶段。(B) 在两个物种中检测到的 PG 数量。(C) 两个物种的蛋白质组学数据的PCA。(D) 维恩图显示同源蛋白质的重叠。(E) 环形图显示每个物种每个阶段中完全识别的蛋白质的前 10 个亚细胞区室的分布。(F) 热图显示发育过程中同源 TF 的蛋白质动态。(G) 所示蛋白质在发育过程中的蛋白质动力学。
02
ZGA 之前和周围的蛋白质动态因物种而异
他们观察到两个物种在植入前发育过程中普遍存在的蛋白质动态(图 2 A),根据它们的动态,将这些蛋白质分为四大类(图 2 B)。第一类是“母体”蛋白质,在卵母细胞中高度表达,并在发育过程中逐渐减少,例如 ZAR1 和 DAZL。为方便起见,除非另有说明,他们将在下文中将主要 ZGA 称为“ZGA”。第二类是“前 ZGA”蛋白质,它们在 ZGA 之前达到最高丰度,可能是此过程所必需的。第三类是在 ZGA 周围表现出最高丰度的 ZGA 蛋白质,可能是 ZGA 转录本的早期产物。最后一类是“后 ZGA”蛋白质,在 ZGA 之后升高,它是谱系特化所必需的,例如 CDX2 和 POU5F1(OCT4)。
有趣的是,人类和小鼠之间近 50%的同源蛋白显示出物种特异性的动态(图 2 C)。为了最大限度地减少低丰度蛋白质的干扰,他们分析了两个物种中排名前 3000 和前 1000 个最丰富的蛋白质,并获得了一致的结果。与母体和 ZGA 后类别中的蛋白质不同,pre-ZGA 和 ZGA 类别中的蛋白质在物种之间表现出显著的差异(图 2 D)。随后,他们根据共同的发育事件进行了分阶段比较(图 2 E)。与小鼠相比,人类不仅在特化阶段而且在 pre-ZGA 阶段都表现出显著的蛋白质组重编程(图 2 F)。秩-秩超几何重叠 (RRHO) 分析进一步证实 pre-ZGA 阶段的蛋白质动力学表现出的一致性低于特化阶段,如热图所示,其中红色区域表示高重叠区域(蛋白质动力学的一致性更高),蓝色区域表示低重叠区域(一致性较低)(图 2 G)。
鉴于这些发现,他们将进一步分析重点放在 ZGA 前阶段。他们使用比 RRHO 分析更严格的定义在人类中鉴定了 2031 个差异表达蛋白(DEP),在小鼠中鉴定了 573 个 DEP(图2H),而只有 67 种蛋白质表现出一致的改变。在两个物种的 ZGA 前阶段,YAP1 等 TF 均表现出类似的上调(图 2 I)。相反,研究较少的 TF,例如 ZNF280C 和 Bnc1,表现出物种特异性的上调(图 2 J)。此外,他们使用 4C 与 1C比较了处于等效形态阶段的物种之间的 DEP,但在小鼠中鉴定的 DEP 增加了一倍,但物种之间的差异仍然存在。

图2. 跨物种分析表明 ZGA 之前和周围存在不同的蛋白质组学动力学。
(A) 热图显示发育过程中的蛋白质动态。(B) 四类蛋白质动力学的示意图。(C) 桑基图说明了人类和小鼠之间四类蛋白质动力学的分布和流动。(D) 人类四类蛋白质动力学的一致比率。(E) 用于比较的四个关键且保守的发展事件。(F) 从四个发育事件中鉴定出的 DEP数量。(G) 来自 RRHO 分析的热图,比较了 ZGA 之前和特化阶段的蛋白质表达。(H) 热图显示从 ZGA 之前阶段鉴定出的 DEP。(I-J) 显示了两个物种中 YAP1、ZNF280C 和 Bnc1 的蛋白质动态。
03
结合翻译数据的综合分析表明,蛋白质和 mRNA 翻译之间存在不同的动态
最近的研究揭示了人类和小鼠植入前发育的翻译动力学。然而,正如 mRNA 水平不一定反映主动翻译一样,核糖体与 mRNA 结合并不能保证蛋白质合成的持续进行。此外,蛋白质稳态进一步受合成和降解之间平衡的调节。接下来,他们将来自两个物种的蛋白质组学数据与同一实验室报告的已发表的翻译数据整合在一起。翻译数据基本上涵盖了鉴定的蛋白质(人类 >88%,小鼠 >93%)。通过整合分析,他们定义了三种主要的行为模式(图 3 A)。第一种模式称为“一致”,表现出翻译和蛋白质水平之间的匹配动态。表现出这种模式的保守蛋白质的例子包括 ZAR1、TEAD1 和 CDX2。第二种模式称为“延迟”,表明蛋白质动力学落后于翻译激活,例如 METTL1、YTHDF2 和 YY1。第三种模式称为“稳定”,表明虽然这些基因在特定阶段表现出翻译增加或减少,但蛋白质水平保持不变,包括 DNMT1、GPX4 和 CDK2。延迟模式在两个物种中都占主导地位(>50%),三种模式显示出高度一致性(>60%)(图 3 B-C)。进一步的分析表明,与其他两种模式相比,稳定蛋白质具有更长的半衰期和更高的丰度,这表明这些差异更可能与蛋白质稳定性而非翻译调控有关。
翻译基因组分析的一个主要目标是了解母体 mRNA 翻译如何调控 MZT。然而,如果没有蛋白质水平的数据,分析就不完整,并可能导致不准确的结论。最近对小鼠 MZT 翻译组的研究确定了受精后主动翻译的 mRNA(图 3 D)。令人惊讶的是,超过 60% 的这些 mRNA 编码的蛋白质已经存在于 MII 卵母细胞中(图 3 E)。值得注意的是,该研究确定了 SWI/SNF染色质重塑复合物的组成部分 Smarcd2 是受精后主动翻译的母体因子(图3 F)。虽然在不同研究中Smarcd2 mRNA 水平从 MII 卵母细胞到 L1C 胚胎保持不变甚至下调;但另一项研究证实了受精后Smarcd2翻译增高。然而,蛋白质组学分析显示 MII 卵母细胞和 L1C 胚胎中的 Smarcd2 蛋白质水平相似,这通过免疫印迹结果得到证实(图3G-H)。
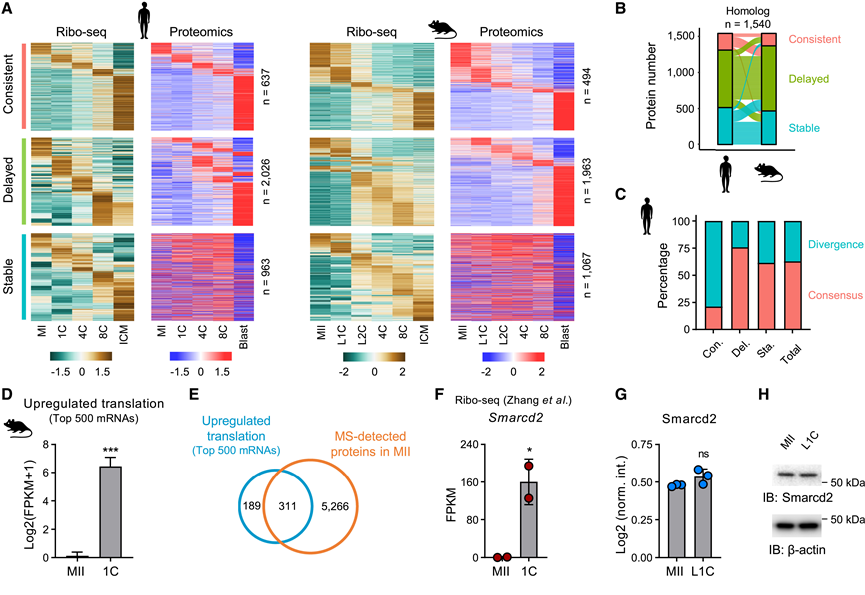
图3. 整合分析揭示翻译激活与蛋白质积累之间的不同调控。
(A) 热图显示了发育过程中翻译和蛋白质丰度的动态。(B) 各物种同源蛋白质中三种动态模式的比例及相应的冲积图。(C) 人类三种动态模式的保守率。(D) 小鼠 L1C 阶段前 500 个母体 mRNA 的翻译上调。(E) 维恩图显示 MII 卵母细胞中上调翻译的前 500 个 mRNA 与 MS 检测到的蛋白质之间的重叠。(F-G) 从 MII 到 L1C 的 Smarcd2 蛋白质丰度。(H)免疫印迹分析。
04
多组学分析发现ZGA转录本可以在胚中积累蛋白质
ZGA 基因通常通过与卵母细胞或早期受精卵相比在一定程度上的转录激活来定义。然而,这些基因在确定的 ZGA 阶段之后如何继续表达以及它们转录本的命运仍然不清楚。他们在人类中总共鉴定了 1744 个 ZGA 基因,在小鼠中鉴定了 2907 个 ZGA 基因(图 4 A)。根据 RNA 谱,这些 ZGA 基因分别可进一步分为两类(图 4 B)。第一类是“瞬时 ZGA(T-ZGA)”,在两个物种中都在 8C 阶段之前或左右表现出最高 RNA 水平。第二种类型是“增加 ZGA(I-ZGA)”,激活后 RNA 持续增加。两个物种中的大多数 ZGA 基因都属于 T-ZGA 类型(图 4 C)。
他们研究了不同 ZGA 基因聚类的核糖体结合动力学,发现 Ribo-seq 信号主要在转录峰附近达到最高水平,这与之前的研究一致。然而,超过60% 的 ZGA 转录本蛋白质产物在母细胞中积累(图 4 D)。具体来说,人类约 54% 的聚类3 (C3) 基因在 8C 时高表达,在母细胞中表现出最高蛋白质水平。这在小鼠中更为明显。在 C1、C2 和 C4 中,ZGA 转录本在 8C 之前或 8C 时达到峰值,超过一半的蛋白质产物也在母细胞中积累(图 4 A-D)。进一步分析表明,蛋白质积累主要不是由于翻译激活延迟造成的。在小鼠的五个聚类中,检测到ZGA 基因产物的比例增加(图 4 A),可能反映了这些基因的表达水平,ZGA 转录本通常有助于母细胞中的蛋白质积累。
他们鉴定了一组称为“ZGA-burst”蛋白的蛋白质,这些蛋白质表现出 T- ZGA 转录激活,但在 Blast 阶段积累(图 4 E)。这些蛋白质在物种之间高度多样化,位于不同的亚细胞区域(图 4 F-G)。例如,ZGA 基因 CTCF 在 8C 阶段后表现出转录降低,但其蛋白质水平在 Blast 中富集(图4 H)。CTCF 的 T-ZGA 表达模式在独立的单细胞转录组分析 (scRNA-seq) 数据集(包括 Mor 和 Blast 阶段)和最近的数据集中都得到了验证(图 4 I)。因此,该多组学分析建立了 ZGA 基因转录与其蛋白质在 Blast 阶段富集之间的时间相关性。
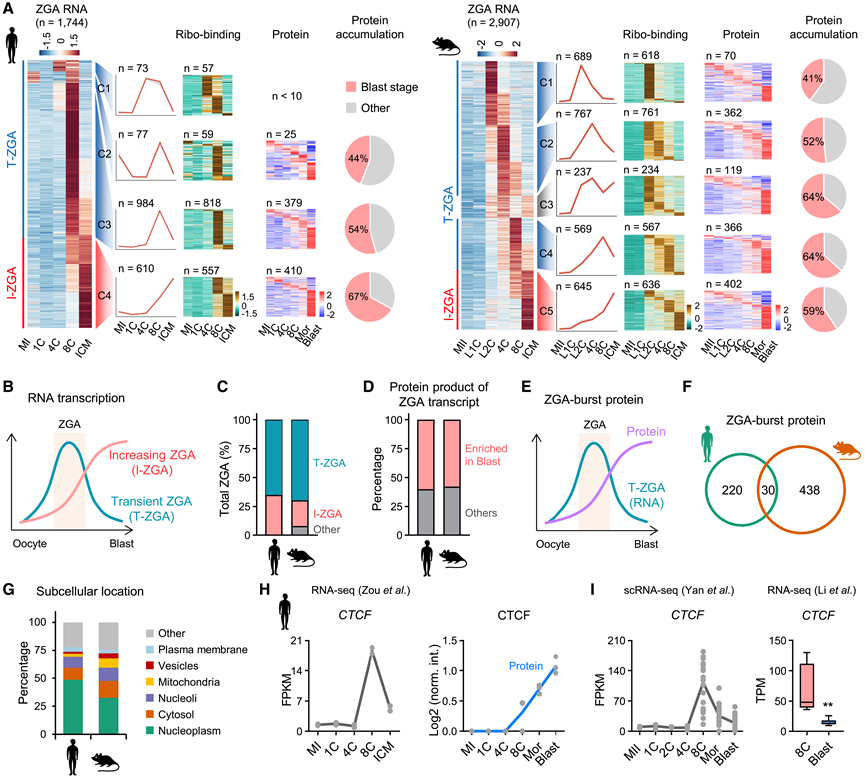
图4. ZGA转录本在胚期促进蛋白质积累。
(A) 热图显示人类和小鼠中 ZGA 基因的 RNA 水平。(B) 根据表达模式绘制的两种 ZGA 基因示意图。(C) 两种类型的 ZGA 基因在已定义的总 ZGA 基因中的比例。(D) ZGA 基因最高蛋白质丰度的分布比例。(E) 定义的 ZGA-burst 蛋白的示意图。(F) 维恩图显示了两个物种之间 ZGA-burst 蛋白的重叠。(G) ZGA-burst 蛋白在亚细胞位置的百分比。(H-I) 人类发育过程中 CTCF 的转录水平和蛋白质丰度。
05
ZGA-burst蛋白参与第一个谱系特化
除了严格定义的 ZGA-burst蛋白外,他们还鉴定出了一些符合标准的其他蛋白质(A 型)(图 5 A)。例如,DNA 拓扑异构酶 Top2a 在 4C 阶段显示出最高的 RNA 表达(但未定义为 ZGA 基因),此后降低,但其蛋白质水平持续增加。其翻译调控反映了其转录,在 L2C 阶段显示出最高水平,此后降低。总共在人类和小鼠中分别鉴定出 318 种和 480 种 A 型蛋白质。GO 分析显示它们参与了多种生物途径,包括核糖体生物合成、组蛋白修饰和蛋白质乙酰化(图 5 B)。
他们从 A 型蛋白中选择了六种研究较少的 TF 候选物,用于小鼠测试。他们使用 CRISPR-Cas9 在受精卵中敲除了这些基因。发现 Hic2、Ttf1 和 Ubtf 对 Blast 形成有显著影响(图 5 C)。文献中证实 Hic2 在纯合缺失时会导致胚胎致死。Ubtf KO的表型与之前的报告一致,他们进一步研究了 Ttf1(转录终止因子 1),这是一种参与核糖体基因转录的核仁定位蛋白。Ttf1 在早期阶段(4C 或 L2C)表现出最高的转录和翻译水平,而其蛋白质水平在整个植入前持续增加(图 5 D)。Ttf1 的缺失不会影响压实前的早期发育,但会阻止 Blast 形成(图 5 E-F)。在 L2C 和 Mor 阶段,Ttf1敲除胚胎和对照胚胎的低输入转录组分析(RNA-seq)表明,在 L2C 阶段对 ZGA 基因的影响最小(图 5 G),但在 Mor 阶段存在显著的失调(图5 H)。GO 分析表明谱系特化失调(图 5 I)。同时,第一个谱系特化所需的 TF,例如Cdx2和Nanog ,在Ttf1缺陷胚胎中表现出表达受损(图 5 J)。上述数据表明,在 Mor-to-Blast 转变过程中,ZGA-burst蛋白(例如 Hic2 和 Ttf1)是第一个谱系特化所必需的。
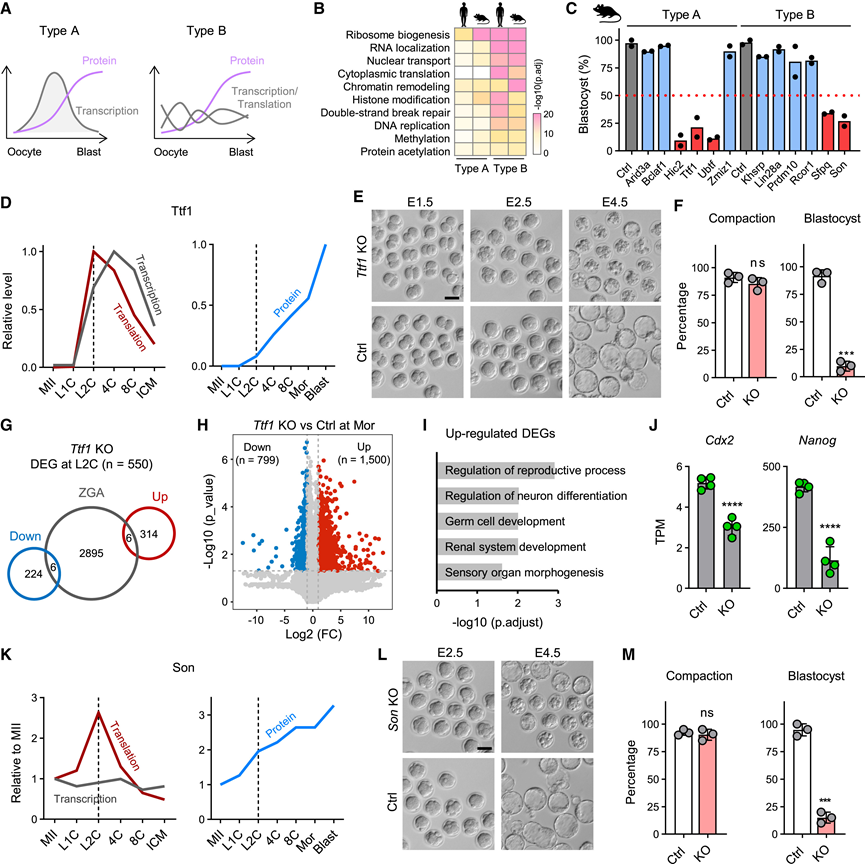
图5. ZGA-burst 蛋白参与第一个谱系指定。
(A) 具有不同转录和翻译动力学的两种增加蛋白质的示意图。(B)GO分析。(C) 总结了对照组和所示基因 KO 组的 Blast 比率。(D) 小鼠发育过程中Ttf1的转录/翻译水平和蛋白质丰度。(E) Ttf1 KO组和对照组的代表性胚胎形态。(F) Son KO组与对照组的胚胎紧密化和胚泡形成比例。(G) 维恩图显示Ttf1 KO胚胎L2C期检测到的差异表达基因(DEG)与确定的ZGA基因之间的重叠。(H) 在桑葚胚阶段检测到的 DEG 的火山图。(I) GO分析。(J) 桑葚胚阶段Ttf1 KO 胚胎和对照胚胎中Cdx2和Nanog的表达水平。(K) 小鼠发育过程中 Son 的转录/翻译水平和蛋白质丰度。(L) Son KO 组和对照组的代表性胚胎形态。(M) Son KO组与对照组的胚胎紧密化和胚泡形成比例。
06
来自不同患者夫妇的 PQ 胚胎具有蛋白质组学鉴别性和异质性
最后,他们探索了人类蛋白质组学图谱,作为理解 PQ 胚胎形成的参考的潜力。受精后,合子经历三个关键转变:第 1.5 天(受精后 28 ± 1 小时)第一次卵裂、第 3 天 ZGA 和第 5 天定型(图 6 A)。他们分析了来自生殖医学中心的患者数据(图 6 B),2022 年,1725 对接受 IVF 的患者夫妇纳入分析。根据伊斯坦布尔胚胎评估共识,第58天(D3)每八个胚胎中就有一个归类为 PQ。与优质 (GQ) 胚胎相比,PQ 胚胎表现出碎片化、不对称和空泡化等特征(图 6 C)。值得注意的是,超过一半(50.3%)的 IVF 患者夫妇至少产生了一个 PQ 胚胎(图 6 D),这凸显了 PQ 胚胎在 IVF 中的普遍性,并表明非遗传因素更有可能是导致其形成的原因。相比之下,只有 23 对患者夫妇(1.3%)只产生了 PQ 胚胎,仅占 PQ 产生人群的 2.6%(23/869)。
然后,他们应用 CS-UPT2 分析了 106 对患者夫妇的 142 个第 3 天 PQ 胚胎(图 6 E),106 对患者夫妇中,81 对产生了一个 PQ 胚胎,而 25 对产生了多个 PQ 胚胎(图 6 F)。此外,还纳入了 9 个 GQ 胚胎进行比较分析。其中五个胚胎来自产生了 PQ 胚胎的患者夫妇,四个胚胎来自未产生 PQ 胚胎的患者夫妇(图 6 G)。重要的是,接受胚胎移植的 IVF 患者夫妇中有 70.2% 怀孕了(图 6 H)。平均而言,在 PQ 和 GQ 胚胎中都鉴定出了大约 4800 种蛋白质(图 6 I),总共鉴定出了 5954 个 PG。
无监督聚类分析显示,PQ 胚胎与 GQ 胚胎相比具有不同的蛋白质组学谱,并在 PQ 胚胎中鉴定出三个亚组(C1-C3)(图 6 J)。这表明 PQ 胚胎表现出可区分的蛋白质组学特征。有趣的是,这些 PQ 胚胎亚组的分类并不受检测到的蛋白质数量、女性患者的年龄或 PQ 胚胎的细胞数量(胚胎分级的关键因素)的影响(图 6 K)。鉴于招募了同时拥有 PQ 和 GQ 胚胎的患者夫妇,结果显示来自同一患者的 PQ 胚胎表现出蛋白质组学差异,而 GQ 胚胎保持相似(图 6 L)。这一观察结果在拥有多个(≥2 个)PQ 胚胎的患者夫妇中得到进一步证实(图 6 M)。值得注意的是,与 GQ 胚胎相比,TPRX1 在 PQ 胚胎的所有亚组中均表现出明显损伤,表明 ZGA 处于受损状态(图 6 N-O)。
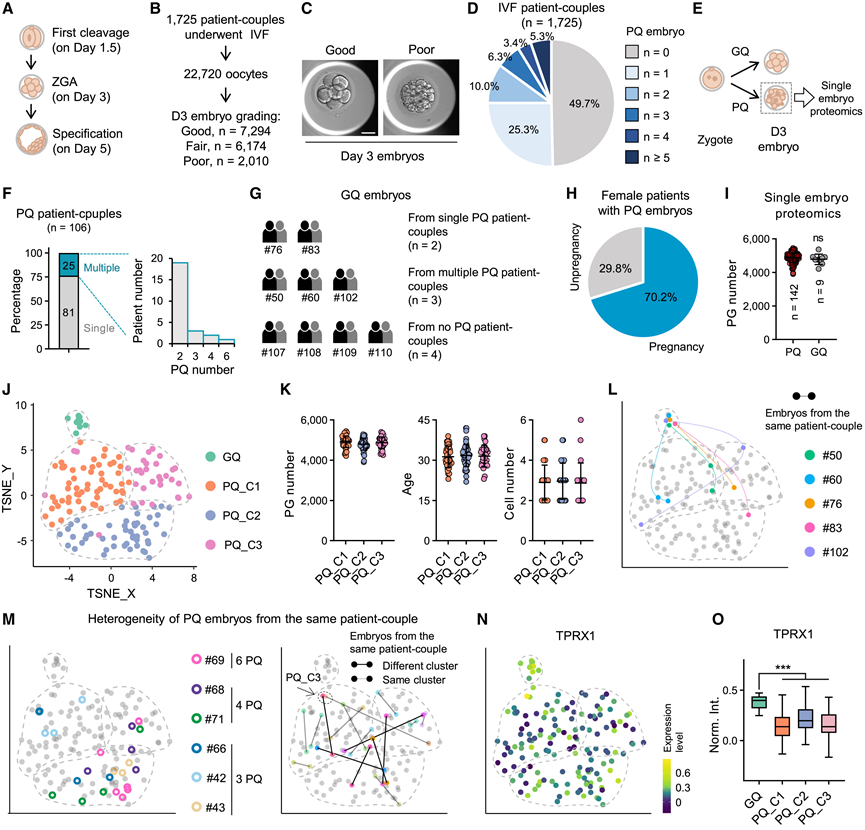
图6. 单胚胎蛋白质组学分析提示PQ胚胎存在异质性。
(A) 人类三个关键发育事件的示意图。(B) 分析临床信息的流程图。(C) 第 3 天 GQ 和 PQ 胚胎的代表性胚胎形态。(D) 饼图显示所分析的 IVF 患者夫妇中不同 PQ 胚胎数量的百分比。(E) PQ 胚胎的 SEP 分析示意图。(F) 拥有不同数量 PQ 胚胎的患者夫妇的百分比。(G) 患者夫妇捐赠了 GQ 胚胎,图中显示了 GQ 和 PQ 胚胎。(H) 饼图显示 PQ 胚胎捐赠个体的怀孕百分比。(I) 在 GQ 和 PQ 胚胎中检测到的 PG 数量。(J) GQ 和 PQ 胚胎的无监督聚类分析。(K) PQ 胚胎不同亚组中的 PG 数量、年龄和细胞数量。(L) 展示从同一对患者夫妇中获得的 GQ 和 PQ 胚胎。(M) 图中显示了从同一患者夫妇获得的 PQ 胚胎。(N) GQ 和 PQ 胚胎中 TPRX1 的标准化蛋白质丰度。(O) 箱线图显示 TPRX1 的标准化蛋白质丰度。
07
PQ 胚胎和 GQ 胚胎蛋白质组学特征的比较分析揭示了人类植入前损伤
随后,他们在 PQ 胚胎的每个亚组和 GQ 胚胎组之间检测到了独特的 DEP(图 7 A)。例如,极光激酶 B(AURKB)是细胞有丝分裂的关键调节因子,它在 C1 中升高,表明 PQ 胚胎亚组中的有丝分裂中断。当将 PQ 胚胎的每个亚组与 GQ 胚胎进行比较时,发现了更多的 DEP(图 7 B)。他们进一步分析了不同亚组中 PQ 胚胎的常见和独特 DEP,这些 DEP 导致它们与 GQ 胚胎分离。大约 40% 的 DEP 在特定的 PQ 胚胎亚组中独特地失调。
他们推断,整合正常胚胎的蛋白质组学景观有助于揭示 PQ 胚胎形成的潜在机制。为此,他们将从 MI 卵母细胞正常发育到 8C 胚胎中鉴定出的蛋白质分为三类:(1)增加,(2)稳定,和(3)减少。PQ 胚胎中只有大约 1/4 的下调和上调蛋白质可以分别用不当降解和合成来解释(图 7 D)。相反,稳定蛋白的失调占总 DEP 的大部分(> 50%)。GO 分析表明稳定蛋白在关键途径中富集,包括氨基酸代谢过程、核糖核苷酸代谢过程和肌动蛋白丝组织(图 7 E)。通过整合转录组和翻译分子数据,他们发现稳定蛋白在翻译(>66%)和转录(>73%)水平上普遍受到动态控制(图 7 F-G)。失调的稳定蛋白的一个例子是 ATG13,它是自噬起始复合物的重要组成部分,它的转录和蛋白质水平保持在稳定水平,而其翻译在 8C 阶段升高(图 7 H)。相反,PQ 胚胎显示 ATG13 蛋白水平降低,表明翻译调控受损(图 7 I)。因此,PQ 胚胎中稳定蛋白的显著失调凸显了协调转录和翻译控制在正常发育中的关键作用。
他们进一步使用蛋白质-蛋白质相互作用 (PPI) 分析可视化了区分 GQ 胚胎和 PQ 胚胎亚组的 TF 和代谢酶 (ME),这些 TF 和酶表现出广泛的相互作用,这可能有助于不同胚胎组的分离(图7J)。例如,ILF3、ALYREF、NONO 和 HNRNPK 形成了一个相互作用中心,该中心在 GQ 胚胎中富集,但在所有 PQ 胚胎亚组中下调(图 7 J)。相反,YAP1 在 C1 和 C2 组中缺乏,而 PSMD14 在 C3 组中缺乏。值得注意的是,TPRX1 未纳入 PPI 网络中,因为有关其与其他蛋白质相互作用的信息有限,强调了未来进行机制研究的必要性。
此外,他们还检测了已知与早期胚胎质量相关的蛋白质。胞质分裂错误会导致非整倍性,这在人类卵母细胞中很常见,并经常导致流产和唐氏综合症等遗传疾病。最近的研究表明,人类卵母细胞在减数分裂 I 期间经常形成不稳定的减数分裂纺锤体。分子马达KIFC1(驱动蛋白家族成员 C1)已知在稳定纺锤体方面起着关键作用,存在于其他哺乳动物卵母细胞中,但在人类卵母细胞中缺乏。传统的检测方法(如免疫印迹)已证明无法有效检测人类卵母细胞裂解物中的 KIFC1。然而,CS-UPT2 使研究者们能够在正常的植入前胚胎中检测到 KIFC1 蛋白,尤其是在 8C 阶段之后(图 7 K)。有趣的是,他们观察到 C2 亚组中 KIFC1 水平显著降低,这表明 KIFC1 的缺乏可能与这些 PQ 胚胎的形成有关(图 7 L)。
正如 TPRX1 可作为 GQ 胚胎中 ZGA 成功的标志一样,他们假设 PQ 胚胎将拥有自己独特的标志。通过将 PQ 胚胎作为一个集体进行分析,发现与 D3 GQ 胚胎相比,有 363 种上调蛋白质(图 7 M)。值得注意的是,NCOA3(也称为 AIB1 或 SRC-3)是一种核受体辅激活因子,显示在所有 PQ 亚组中都该蛋白质富集(图 7 N-J)。此外,他们在由 10 个 GQ 胚胎和 21 个 PQ 胚胎组成的独立数据集中检查了NCOA3在第 3 天的 mRNA 水平,NCOA3表达在 PQ 胚胎中显著上调(图 7 O)。总的来说,这些研究结果强调了 SEP 在揭示 PQ 胚胎形成过程中可能存在的失调方面的潜力。

图7. PQ 胚胎的不同亚群揭示了其形成的潜在失调。
(A) 热图显示 GQ 胚胎和 PQ 胚胎中亚组之间的总 DEP。(B) GQ 胚胎和 PQ 胚胎各亚组之间的 DEP 数量。(C) 正常发育过程中定义的蛋白质动力学示意图。(D) 属于不同动态类型的 DEP 的比例。(E) 稳定蛋白质的GO分析。(F-G) 转录和翻译水平的动态调节基因与稳定蛋白的比值及这些动态调节基因的相应热图。(H) 发育过程中 ATG13 的相对转录/翻译和蛋白质水平。(I) 箱线图显示 ATG13 的标准化蛋白质丰度。(J) 差异表达 TF 及其相互作用 DEP 的 PPI 分析。(K) 发育过程中 KIFC1 的标准化蛋白质水平。(L) 箱线图显示 KIFC1 的标准化蛋白质丰度。(M) 热图显示 PQ 胚胎中上调的蛋白质。(N) 箱线图显示 NCOA3 的标准化蛋白质丰度。(O) 箱线图显示GQ 和 PQ 胚胎中NCOA3的转录水平。
+ + + + + + + + + + +
结 论
本研究应用了超灵敏蛋白质组学技术的综合解决方案来测量卵母细胞和早期胚胎的蛋白质组学谱,并鉴定了人类近 8000 种蛋白质和小鼠 6300 多种蛋白质,观察到两个物种在ZGA之前和周围存在不同的蛋白质组学动态。与翻译数据的综合分析揭示了翻译激活和蛋白质积累之间存在广泛的差异。多组学分析表明 ZGA 转录本通常有助于胚泡中的蛋白质积累。利用小鼠胚胎,本研究鉴定了几种对早期发育至关重要的转录调控因子,从而将 ZGA 与第一个谱系特化联系起来。此外,对来自 100 多对患者夫妇的低质量胚胎进行单胚胎蛋白质组学研究,为植入前发育失败提供了见解。
+ + + + +



 English
English


