文献解读|Nat Commun(14.7):免疫疗法可改善高级别浆液性卵巢癌的化疗反应
✦ +
+
论文ID
原名:Immunotherapy that improves response to chemotherapy in high-grade serous ovarian cancer
译名:免疫疗法可改善高级别浆液性卵巢癌的化疗反应
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.22
DOI号:10.1038/s41467-024-54295-x
背 景
高级别浆液性卵巢癌 (HGSOC) 是最常见的卵巢癌类型,其特征是高体细胞拷贝数变异和肿瘤内异质性。同源 DNA 修复缺陷 (HRD) 肿瘤患者对铂类疗法反应良好,可从 PARP 抑制剂中获益,但 50% 的患者不属于此类别。高折叠倒置 (FBI) 的 HGSOC 肿瘤以广泛的上皮间质转化 (EMT)、幼稚 T 细胞浸润和低肿瘤抗原性为特征。这些患者对铂类化疗反应不佳,因此在治疗方面面临特殊挑战。
实验设计
结 果
01
新辅助化疗 (NACT) 对巨噬细胞具有促肿瘤和抗肿瘤作用
为了研究化疗对 HGSOC 的潜在影响,研究团队对 7 名患者的大网膜转移中的免疫富集细胞进行了单细胞转录组分析(scRNA-seq);3 名患者接受了原发性减瘤手术 (PDS)(28962 个细胞),4 名患者接受了新辅助化疗 (NACT)(35135 个细胞)。
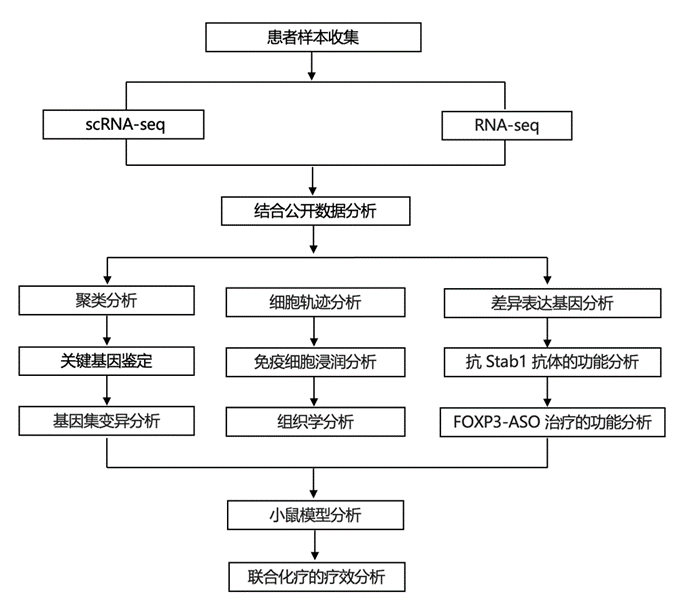
将14672 个单细胞注释为 11 个聚类中的单核细胞/巨噬细胞(图 1A)。聚类以其上调最多的基因命名(图 1B)。聚类M0 的STAB1、SIGLEC1和ISG15表达最高,聚类M1 的SELENOP和GPNMB基因表达较高。聚类M2 中的巨噬细胞表达 MHCII 和补体基因,而聚类4 和 5 分别额外表达 T 细胞趋化基因CCL3 / CCL4和CXCL9/10/11。聚类M3 和 M7 以S100A8/9表达和其他单核细胞/早期巨噬细胞基因为特征。聚类M8 和 M9 显示MMP9高表达,M6 代表增殖巨噬细胞。最后,M10 表达高水平的金属硫蛋白基因。患者的各巨噬细胞聚类比例存在差异,NACT 后聚类 M0、M1、M2、M4 均有扩增。
他们利用基因集变异分析 (GSVA) 研究巨噬细胞聚类中差异富集的通路(图 1C)。巨噬细胞聚类分为两大类。聚类M2-M5 在抗原呈递、T/B 细胞活化和补体通路(APC 聚类)中显著富集。其余聚类则在 ECM 调节和血管生成通路(ECM 调节聚类)中富集。将 APC 聚类与 ECM 调节聚类进行比较,他们发现吞噬体特异性蛋白酶和吞噬体酸化基因(例如CTSB、CTSD、CTSL和TCIRG1)显著下调,这些基因负责靶抗原降解,而炎症和 T 细胞趋化基因则上调。这表明 ECM 调节巨噬细胞聚类会降解吞噬抗原,并降低抗原呈递能力。
与 PDS 样本相比,他们发现 NACT 样本中的巨噬细胞清道夫受体(例如STAB1、MSR1、CD163)和吞噬体蛋白水解蛋白酶(例如CTSB、CTSL和CTSD)显著上调。然而,血管生成和 ECM 调节基因在 NACT 样本中下调(图 1D)。GSVA 在 NACT 样本中显示吞噬、补体途径、抗原加工和呈递显著上调,溶酶体和吞噬溶酶体通路上调(图 1E)。特别令人感兴趣的是稳定蛋白-1 (STAB1),这是一种巨噬细胞清道夫受体,在 NACT 后在大多数聚类中表达和上调(图 1F)。STAB1 是一种多功能清道夫受体,具有细胞内分选功能,通过溶酶体降解通路吞噬清除凋亡细胞。STAB1是替代激活巨噬细胞的标志物,在几种实体癌中,表达增加与预后较差有关。
他们从之前发表的HGSOC 患者(4 例 PDS,12 例 NACT)的独立队列的转录组分析(RNA-seq)数据中验证了 NACT 后STAB1 的上调。NACT 样本中 CD68 和 STAB1 阳性细胞显著增加(图 1G)。STAB1 阳性巨噬细胞广泛分布于基质区域和恶性区域。在接受 3 个周期和 6 个周期 NACT 的患者之间,以及 BRCA 突变和 HRD (BRCAm/HRD) 肿瘤与 BRCA 野生型和非 HRD 肿瘤 (BRCA-WT) 之间的 STAB1 水平没有显著差异。然而,在所有亚组分析中,NACT 样本中的 STAB1 水平均显著高于 PDS 样本。通过观察化疗反应评分评估的治疗反应后的 STAB1 表达变化,仅在网膜中没有残留肿瘤的 CRS3 样本中 STAB1 阳性细胞显著降低。在 NACT 样本中,在附件肿瘤中也观察到较高的 STAB1 水平。他们证实了在 42 名具有患者匹配的 NACT 前和 NACT 后样本的患者队列中 NACT 后 STAB1 阳性巨噬细胞增加(图1I-J)。在 BRCA-WT 和 BRCAm/HRD 肿瘤中观察到 STAB1 阳性巨噬细胞增加,然而在患者匹配队列中的 BRCAm/HRD 组中并不显著(图 1J)。NACT 后肿瘤巨噬细胞 STAB1 浸润高的患者 PFS 和 OS 明显差于巨噬细胞 STAB1 水平较低的患者(图 1K),但这对于 NACT 前 STAB1 水平并不显著。ICGC 数据集中的M0:STAB1 聚类基因富集分数高的 HGSOC 患者生存率明显差于分数低的患者。
在 NACT 后样本中,巨噬细胞浸润和STAB1 表达有所增加。与清道夫受体、吞噬作用和抗原呈递相关的通路显著上调,但也有通路上调,表明抗原降解增加,这可能会降低 NACT 的任何抗肿瘤免疫作用。
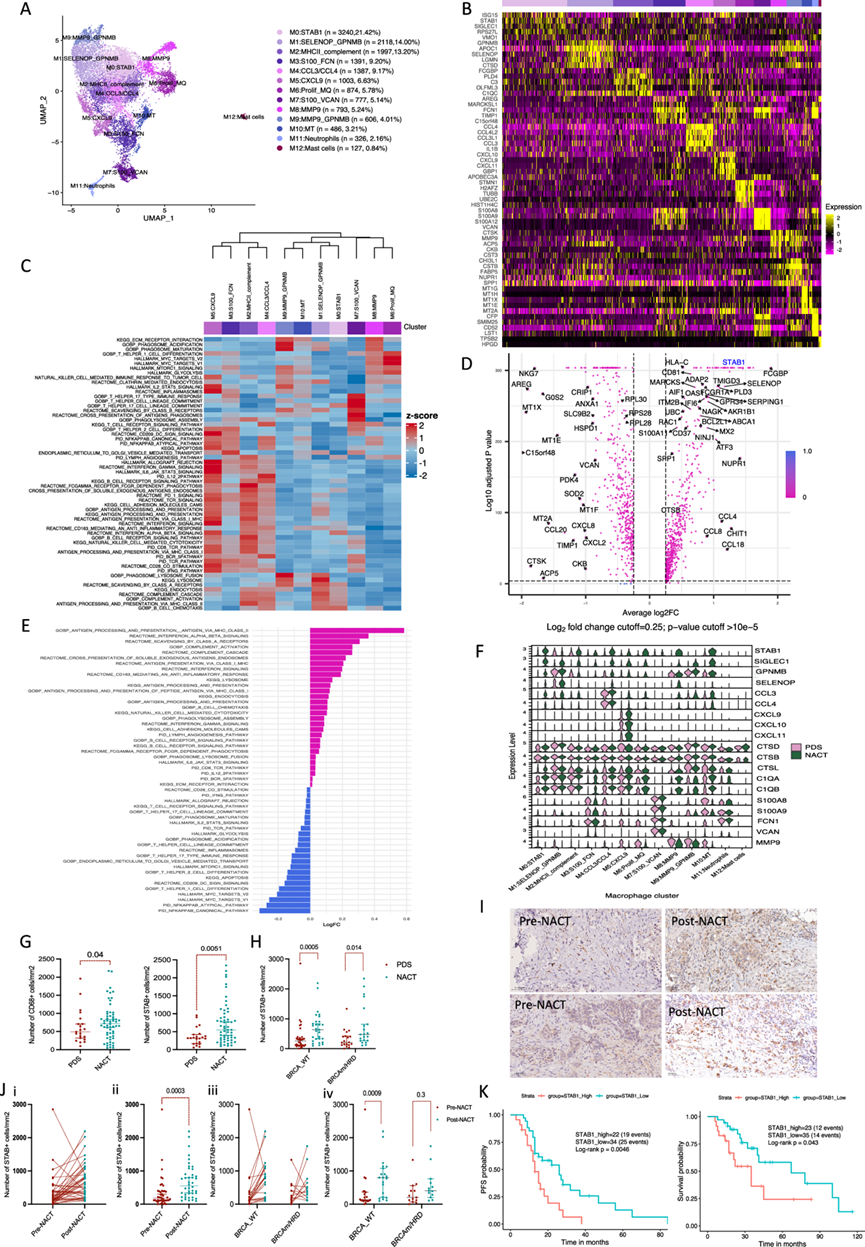
图1. HGSOC 网膜转移中的人类髓细胞亚群。
(A) UMAP 显示 来自 7 名患者(3 名 PDS 和 4 名 NACT)的整合髓系细胞亚群。(B) 热图显示每个聚类中上调最多的五个基因。(C) 巨噬细胞聚类中的差异富集通路,GSVA 分析。(D) 差异表达基因分析。(E)差异富集通路分析。(F) 每个巨噬细胞聚类中 PDS(粉色)和 NACT(绿色)中选定基因表达水平的小提琴图。(G) HGSOC 网膜mm2 的CD68和 STAB1 阳性细胞。(H) 比较BRCA 野生型和 BRCA 突变/HRD 患者的 PDS 和 NACT 中的 STAB1 阳性细胞/mm2。(I) 免疫组织化学染色。(J) 患者匹配样本中的 STAB1 阳性细胞。(K) Kaplan -Meier 生存和 PFS 曲线。
02
NACT 增加调节性 T 细胞 (Tregs) 在肿瘤中的浸润
他们鉴定出十三聚类 CD4 T 细胞(10427 个细胞)(图 2A)。有两个 CD4 幼稚记忆聚类表达TCF7、CCR7和SELL,两个效应记忆 T 细胞聚类表达CD40LG、ANXA1、CD69和ZFP36。有一个聚类具有高表达干扰素刺激基因 (ISG) ,一个聚类为功能失调前和功能失调的 CD4 细胞,分别具有高水平的CXCL13和NMB。他们鉴定出五个由FOXP3表达定义的 Tregs聚类(图 2B)。所有患者中都有所有 CD4 聚类,但百分比各不相同。通路富集分析将 CD4 T 细胞聚类为幼稚组、效应组、功能失调组和调节组。
NACT 组中约 30% 的 CD4 T 细胞为幼稚 T 细胞。NACT 显著上调FOXP3和 ISG 基因(图 2C)。Tregs 聚类中的活化和功能失调基因(例如ICOS、PDCD1、TIGIT和LAG3)高于其他 CD4 聚类(图 2D)。他们接下来详细地研究了 Tregs 聚类,发现 Tregs 占所有 CD4 T 细胞的 26.7%。CD4_Tregs1 和 2 聚类具有免疫抑制特征,其中 CD4_Tregs2 聚类表达更高水平的ICOS和PDCD1。另外两个聚类分别表达 ISG和增殖相关基因。
使用 Slingshot 进行轨迹推断,预测了一条将 Tregs 聚类与功能失调前、效应和幼稚记忆 T 细胞聚类连接起来的轨迹(图 2E)。他们还发现 Tregs 聚类与幼稚记忆、效应、功能失调 T 细胞和其他 Tregs 聚类共有一些 TCR 克隆型(图 2F)。因此,他们假设 Tregs 可能与 TME 中的其他 CD4 T 细胞在发育上相关,这些 CD4 T 细胞可能已重新极化为免疫抑制性 Tregs,而不是天然/胸腺 Tregs。
NACT 后大网膜肿瘤中 CD3 和 CD4 细胞浸润增加,但这仅对 CD3 细胞具有统计学意义(图 2G)。然后他们使用 IHC 对 80 名 HGSOC 患者的大网膜样本研究了两种 CD4 T 细胞亚型:Tregs和 T 辅助细胞。与 PDS 样本相比,NACT 样本中 FOXP3 阳性细胞的数量显著增加,但 TBET 阳性细胞没有变化(图 2H)。在接受三轮和六轮 NACT 的患者样本之间或 BRCAm/HRD 和 BRCA-WT 肿瘤之间,FOXP3 阳性细胞的数量没有差异。然而,在亚组分析中,NACT 样本中的 FOXP3 阳性细胞显著高于 PDS 样本。仅 CRS3 样本中的 FOXP3 水平显著降低。NACT 后,肿瘤中的 FOXP3 阳性细胞也显著增加。42 例 NACT 前后样本匹配的患者队列进一步证实了 NACT 后 FOXP3 阳性细胞的增加(图 2 J-K)。在 BRCA-WT 和 BRCAm/HRD 肿瘤中均观察到 NACT 样本中 FOXP3 阳性细胞的增加,但在患者匹配队列中的 BRCAm/HRD 组中并不显著。NACT 后 FOXP3 浸润水平高的患者 PFS 明显差于 FOXP3 浸润水平低的患者(图 2L)。他们没有发现 NACT 后 CD4 细胞出现显著的克隆扩增(图 2M),这可能是由于 NACT 后非特异性 T 细胞激活、研究样本数量少或缺乏患者匹配的样本。
总之,NACT 样本中的 CD3 T 细胞浸润和 FOXP3 阳性细胞较高。
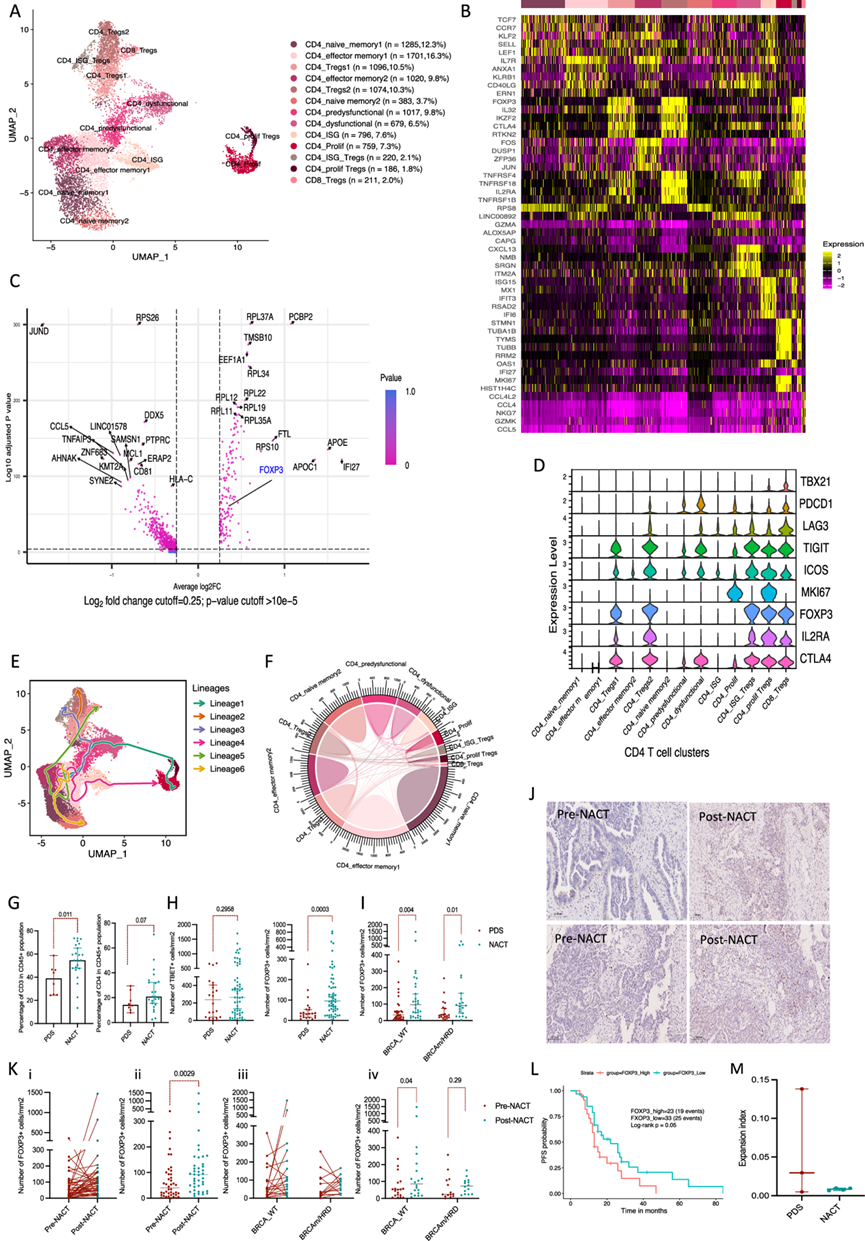
图2. HGSOC 网膜转移中的人类 CD4 T 细胞亚群。
(A) UMAP 显示 7 名患者的整合 CD4 T 细胞聚类,NACT 前和 NACT 后分别为 4492 个和 5935 个细胞。(B) 热图显示每个聚类中上调最多的五个基因。(C) NACT与 PDS 中的差异表达基因分析。(D) 小提琴图显示 CD4聚类中不同 Tregs 和耗竭基因的表达。(E) CD4 细胞亚群的Slingshot轨迹分析。(F) Circos图显示 CD4 细胞聚类中的 TCR 和共有克隆。(G-I)流式细胞分析。(J)免疫组织化学分析。(K) 流式细胞分析。(L) Kaplan-Meier 生存曲线。(M) 通过 STARTRAC 研究的 PDS 和 NACT 中的 CD4 TCR 扩增指数。
03
NACT 对 CD8 和 NKTgd 细胞的影响
他们鉴定了 15 个 CD8 细胞聚类(24155 个细胞)(图 3A)。三个聚类为幼稚记忆 T 细胞,表达CCR7、SELL、TCF7和GZMK,四个细胞毒性 CD8 T 细胞聚类表达NKG7和GZMH,其中一个细胞毒性聚类还表达高水平的 DC 趋化因子XCL1。表达CCL3L/CCL4L的聚类可以与表达相关受体的炎症髓系细胞相互作用。 NKT 细胞聚类表达最高水平的GZMB、PERF1和GNLY,而功能失调前和功能失调的 CD8 细胞聚类分别表达高水平的CXCL13和PDCD1。有一个增殖 CD8 细胞聚类和一个表达 ISG 的 CD8 细胞聚类(图 3B)。除一个聚类(CD8_CXCR6)外,每个患者每个聚类的百分比各不相同,该聚类主要由来自患者 S2(PDS)的细胞组成。
NACT 样本显示树突状细胞趋化因子和细胞毒性基因(例如CCL3、CCL4、GZMB)显著上调(图 3C-D),表明 T 细胞细胞毒性和髓系细胞参与度增加。流式细胞显示,31 名患者接受 NACT 治疗的 HGSOC 网膜转移瘤中 CD8 T 细胞显著增加(图 3E)。
根据 CD3 的γ 链和δ链的表达,他们鉴定出 5 个 NK 细胞亚群(2780 个细胞)和 4 个 T γ δ 细胞(Tgd)(图 3F)。NK 亚群要么是细胞毒性的(NK.SPON2),要么是树突状细胞的化学引诱剂(NK.KRT86),要么是耗竭的 NK.KRT86(图 3G)。各个样本中每个聚类的比例各不相同。NACT 增加了化学引诱剂 NK 细胞,但没有增加细胞毒性 NK 细胞,并且增加了 NK 细胞浸润。
图3. HGSOC 网膜转移中的人类 CD8 T 细胞亚群。
(A) UMAP 显示上述 7 位患者的综合 CD8 细胞聚类。(B) 热图显示每个聚类中上调最多的基因。(C) CD8 T 细胞 NACT 与 PDS 中的差异表达基因。(D) CD8细胞中 NACT 与 PDS 中差异富集的通路。(E) 流式细胞分析。(F) UMAP显示来自 7 位患者的综合 NKTgd 细胞聚类。(G) 热图显示 NKTgd 亚群中每个聚类中上调最多的五个基因。(H) NACT 与 PDS 中 NKTgd 细胞的差异表达基因。
04
抗稳定素1(抗STAB1)抗体治疗延迟了抗原降解并提高了体外T细胞杀伤力
为了研究抗 STAB1 抗体对巨噬细胞的影响,他们进行了一系列体外实验来研究吞噬、抗原处理和分泌功能。在重组人 MCSF 30存在下培养来自健康人 PBMCs 的单核细胞。在第 5 天,用同种型或抗 STAB1 抗体处理巨噬细胞,然后在第 6 天用地塞米松和 IL4 处理以诱导 STAB1 表达;用 IFNγ 处理以诱导 M1 样极化;用卡铂或紫杉醇 (CT)处理。在 GMCSF、IL4 和 IFNγ中培养单核细胞获得的单核细胞衍生的树突状细胞 (moDC)充当阴性对照,因为它们不表达 STAB1。他们用 Phrodo® 涂层的死癌细胞培养上述条件下的第 7 天巨噬细胞,并用 Incucyte S3 进行成像。巨噬细胞在几分钟内吞噬死细胞,由于吞噬溶酶体的酸性 PH 值,红色强度逐渐增加,随后由于受到吞噬细胞的降解影响导致红色信号下降。阻断 STAB1 受体不会改变巨噬细胞的吞噬能力,但与同种型对照相比,抗 STAB1 抗体处理的巨噬细胞中红色物体平均强度保持较高时间更长,表明抗原降解延迟(图 4A-B)。使用抗 STAB1 抗体处理后,moDC 细胞的吞噬能力或红色信号强度没有变化。
为了研究抗 STAB1 抗体处理对抗原降解的影响,他们向巨噬细胞中添加了 DQ™-卵清蛋白,并使用 Incucyte S3 进行成像。DQ™-卵清蛋白以 pH 无关的方式在蛋白酶降解时发出绿色荧光。用抗 STAB1 抗体处理的巨噬细胞在所有培养条件下的抗原降解率均显著低于同种型处理的巨噬细胞,甚至低至已知抗原降解水平较低的树突状细胞。使用 LysoSensor™ 绿色荧光染料,抗 STAB1 抗体处理的巨噬细胞在所有培养条件下的溶酶体酸度均显著低于同种型处理的巨噬细胞。流式细胞分析显示,抗STAB1处理的巨噬细胞的溶酶体LAMP1表达明显低于同种型处理的巨噬细胞。与同种型处理的巨噬细胞相比,抗STAB1处理的巨噬细胞的TNFα和CD11C表达明显较高,PDL1表达较低,表明抗STAB1抗体处理后巨噬细胞复极化(图 4C)。
接下来,他们检测了抗 STAB1 抗体处理的巨噬细胞的条件培养基对 T 细胞表型、活化和杀伤的影响。将 T 细胞在抗 STAB1 或同种型抗体处理的巨噬细胞的巨噬细胞上清液、活化纳米珠和 IL-2 中培养 3 天。第 4 天,收获活化的 T 细胞并与活红色慢病毒转导的 G164 细胞共培养,并在 Incucyte S3 中对板进行成像。或者,收获 T 细胞进行流式细胞术分析。在抗 STAB1 抗体处理的巨噬细胞的条件培养基中培养的 T 细胞表现出明显优于在同种型处理的巨噬细胞的条件培养基中培养的 T 细胞,表明前者具有更多的 T 细胞活化介质(图 4D-E)。流式细胞分析证实了这一点,结果显示,与同种型处理的巨噬细胞相比,抗STAB1抗体处理的巨噬细胞上清液中培养的T细胞中Ki67的表达更高,CD4 TBET的表达更高,CD8颗粒酶B的表达更高(图 4F)。
抗 STAB1 抗体延迟了抗原降解,使巨噬细胞重新极化为表达 CD11C 的巨噬细胞,增加了 TNFα 分泌,并改变了巨噬细胞的细胞因子谱,使其更具 T 细胞活性。重要的是,抗 STAB1 抗体不会减少与自身免疫有关的凋亡细胞摄取,但会改变巨噬细胞处理吞噬抗原的方式,从而可能增强抗肿瘤免疫反应。
为了靶向 Tregs,他们使用了 FOXP3 反义寡核苷酸(FOXP3-ASO),该寡核苷酸可选择性敲低人类和小鼠 Tregs 中的 FOXP3 并抑制 Tregs 功能。从健康人类 PBMCs 中分离出泛 T 细胞,用 TransACT 珠和 IL-2 激活。然后在存在或不存在 rhTGFβ 的情况下用 FOXP3-ASO 或siRNA (CTL-ASO) 处理 T 细胞以诱导稳定的 FOXP3 表达。
他们研究了第 3-9 天的 T 细胞活化和增殖情况。CD4 FOXP3 表达显著减少,CD4 T 辅助细胞 (TBET+) 增多,CD4 和 CD8 增殖随时间推移逐渐增加,与 CTL-ASO 处理的细胞相比,FOXP3-ASO 处理的 T 细胞中 CD4 和 CD8 增殖明显增加。第 3 天和第 5 天,穿孔素表达增加,CD4 和 CD8 细胞中的耗竭标志物(CTLA4 和 LAG3)显著减少(图 4G)。即使将 T 细胞与 rhTGFβ 一起培养,大多数变化仍能维持。与 CTL-ASO 处理的 T 细胞相比,用 FOXP3-ASO 处理的活化 T 细胞对 G164 HGSOC 细胞系的杀伤力明显更好(图 4H-I)。
FOXP3-ASO 治疗提高 T 细胞杀伤力很可能是由于 Tregs 百分比的降低和细胞因子释放的变化导致其对 CD8 T 细胞的抑制作用降低。体外 FOXP3-ASO 治疗可减少幼稚 T 细胞向调节性 T 细胞的极化,减少 T 细胞耗竭并改善 T 细胞活化、增殖和杀伤。
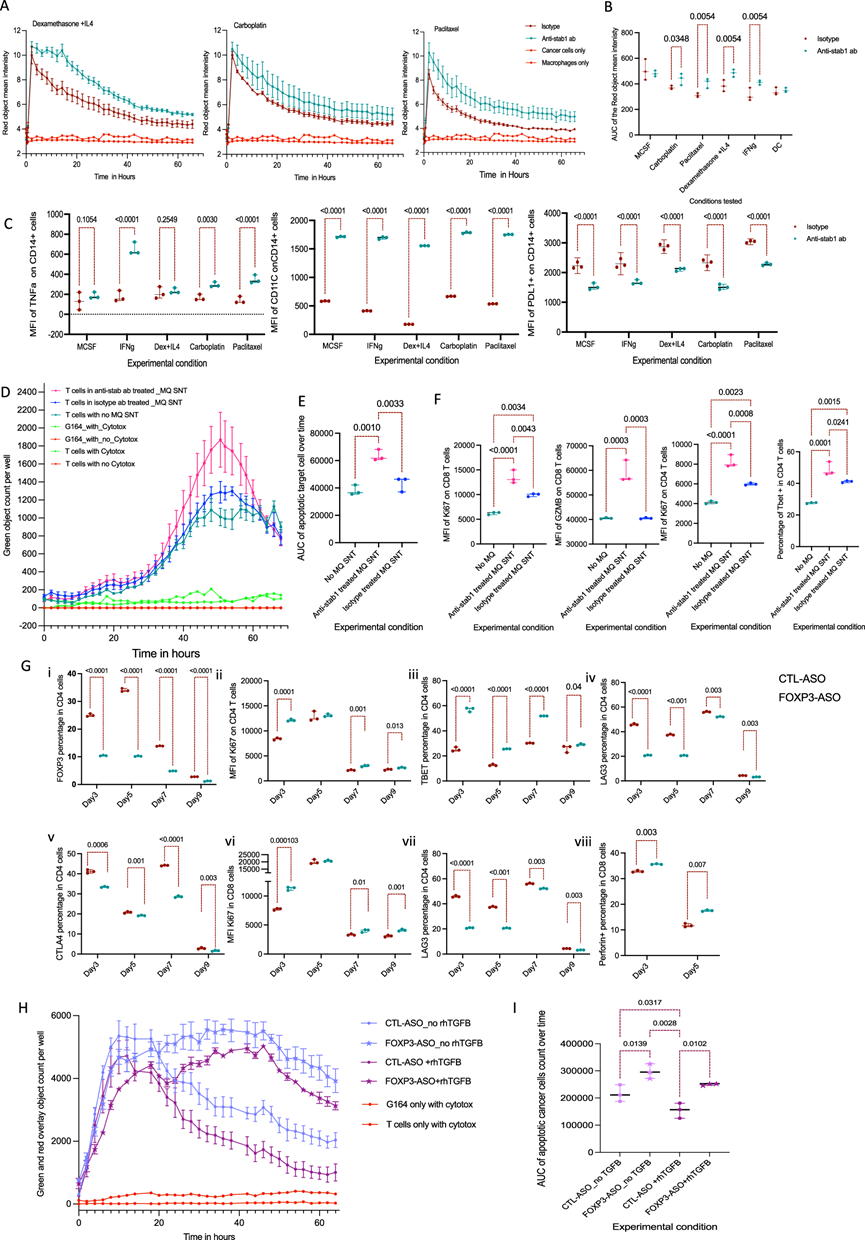
图4. 抗STAB1抗体和FOXP3-ASO体外治疗的效果。
(A) Incucyte 人巨噬细胞吞噬曲线。(B)曲线下面积 (AUC)。(C) 流式细胞分析。(D) Incucyte S3曲线显示 T 细胞杀伤G164 卵巢癌细胞系。(E) AUC分析。 (F) T 细胞的流式细胞分析。(G) FOXP3-ASO 随时间的影响。(H) Incucyte S3曲线显示 T 细胞随时间杀死 G164 细胞的情况。(I) T 细胞杀伤曲线的 AUC。
05
小鼠髓系细胞在 HGSOC 网膜转移中复制人类巨噬细胞
他们鉴定出 11 个单核细胞/巨噬细胞聚类(12436 个细胞)(图 5A)。巨噬细胞聚类复制了大多数人类巨噬细胞聚类,但比例不同,其中主要的小鼠巨噬细胞表型是 ECM 调节巨噬细胞(M0:Mmp9、M3:Nrp2、M6:Tyrobp 和 M8:ECM/血管生成)(图 5B)。他们发现单核细胞/早期巨噬细胞聚类表达S100a8/9基因和Il1b,而其他聚类则表达Cxcl9、ISG、补体成分、MHC II 类和增殖基因。与人类巨噬细胞的相似性分析(图 5C)显示聚类间相似性很高。与人类数据一样,这些聚类分为两大类,一组与抗原呈递、适应性免疫激活和化学吸引有关,另一组负责 ECM 和血管生成调节(图 5D)。
与未经治疗的小鼠肿瘤相比,CT治疗的肿瘤中的巨噬细胞显示出吞噬基因(如STAB1、Mrc1、Mertk)的显著上调,以及 ECM 和血管生成基因(如Mmp9和Col1a1)的下调(图 5E)。通路富集分析支持上述发现,并显示 CT 后抗原呈递和适应性免疫激活通路上调。与患者肿瘤一样,抗原降解通路也显著上调。他们利用流式细胞对接受 CT 治疗的小鼠和对照小鼠进行了验证,证实了 CT 治疗小鼠网膜肿瘤 STAB1 表达的增加(图 5F),得出结论,小鼠巨噬细胞复制了人类巨噬细胞聚类的大部分特征,并对 CT 作出反应,并上调STAB1。
他们鉴定了 7 个 CD4 聚类(10826 个细胞)(图 5G),其中包括幼稚 T 细胞、效应 T 细胞和调节性 T 细胞。同样,小鼠和人类 CD4 T 细胞聚类之间具有高度相似性(图 5H)。Tregs占四个与人类聚类相似的聚类中总 CD4 T 细胞的 15.8%:两个免疫抑制聚类、ISG-Tregs和增殖性 Tregs(图 5I-J)。Slingshot 分析表明轨迹始于幼稚 CD4 T 细胞并结束于 Tregs(图 5K)。
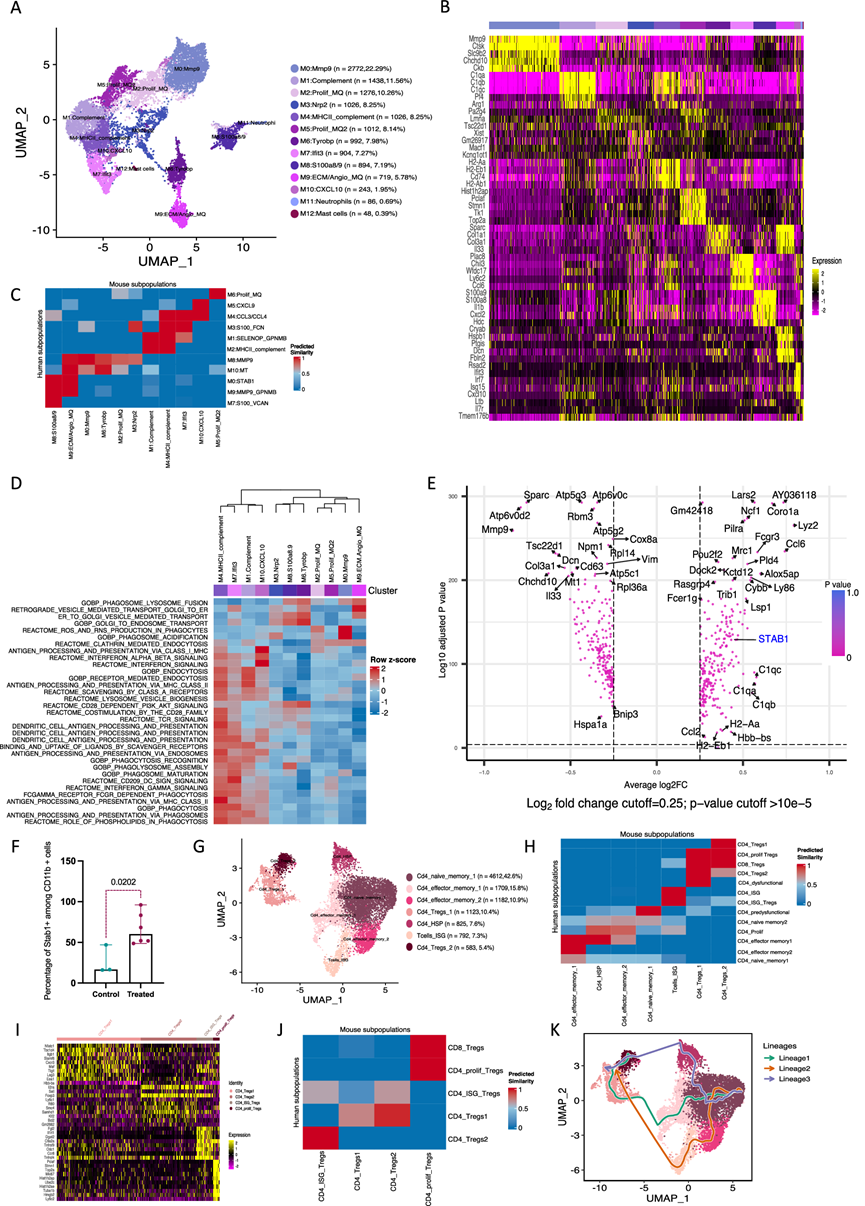
图5. HGS2 网膜肿瘤中的髓系亚群。
(A) 小鼠巨噬细胞亚群的整合 UMAP。(B) 每个聚类上调前五个基因的热图。(C) HGS2和人类髓系细胞聚类之间的相似性分析。(D) 使用GSVA 分析在巨噬细胞聚类中差异富集的通路。(E) CT治疗小鼠与对照小鼠的差异表达基因。(F) 使用流式细胞技术检测 HGS2 网膜肿瘤巨噬细胞中 STAB1 阳性细胞的百分比。(G) 对照小鼠和 CT 治疗小鼠的整合小鼠 CD4 亚群的UMAP。(H) HGS2 和人类 CD4 细胞聚类之间的相似性分析。(I) 每个 Tregs 聚类的上调基因的热图。(J) 人类和小鼠Tregs 细胞聚类之间的相似性分析。(K) CD4 T 细胞的Slingshot轨迹分析。
06
FOXP3 抑制和/或阻断 STAB1 可改善两种同源小鼠模型的化疗反应并延长生存期
他们用抗 STAB1 抗体或 FOXP3-ASO(AZD8701 的鼠类替代物)作为单一疗法和与 CT 联合治疗患有已确诊腹膜疾病的 HGS2 小鼠。实验进行了两次,包括对照、CT、抗 STAB1 抗体作为单一疗法或与 CT 联合、FOXP3-ASO 作为单一疗法或与 CT 联合,以及 CT、抗 STAB1 抗体和 Foxp-3-ASO 的三重组合组。小鼠在任何治疗中均未表现出任何自身免疫或其他不良反应的迹象。抗 STAB1 抗体与 CT 联合使用可显著提高小鼠的存活率,而单纯使用 CT 则可提高 98 天和 83 天,P = 0.0001,其中 15 只小鼠中有 3 只可长期存活。此外,FOXP3-ASO 与 CT 联合使用可显著提高小鼠的存活率,而单纯使用 CT 则可提高 145 天和 83 天,P < 0.0001,其中 17 只小鼠中有 5 只可存活超过 250 天。FOXP3-ASO 与 CT 和抗 STAB1 抗体的三重组合比单独使用 CT 和 CT 加抗 STAB1 抗体以及 CT 加 FOXP3-ASO提高了生存率,在三重组合治疗组中,十六只小鼠中有七只存活超过 250 天。抗 STAB1 抗体单一疗法可带来较小但具有统计学意义的生存益处。FOXP3-ASO 单一疗法和与抗 STAB1 抗体联合疗法均未带来生存益处。与对照组或单独进行 CT 治疗相比,CT 加抗 STAB1 抗体治疗组、CT 加 FOXP3-ASO 组和三联治疗组在人道主义终点时的腹膜肿瘤重量明显较低(图 6B)。在对相同治疗组进行的进一步实验中,他们在 70 天时收获了肿瘤。CT 加抗 STAB1 和/或 FOXP3-ASO 治疗组的肿瘤重量明显低于对照组和 CT 治疗组(图 6C)。
他们在第二个非 EMT HGSOC 同系小鼠模型 30200中对已确诊的腹膜疾病测试了相同的治疗组合。CT 组的生存优势明显优于对照组。与 CT 相比,抗 STAB1 抗体加 CT 进一步提高了生存率。CT 与 FOXP3-ASO 或 CT 加 FOXP3-ASO 加抗 STAB1 抗体相结合比单独进行 CT 显著提高了生存率。
上述 HGS2 小鼠实验中的长期幸存者在第一次 HGS2 注射后 250-260 天再次注射 HGS2 细胞,在临床和放射学上确认没有可检测的肿瘤后。对照组小鼠的年龄相似,之前未接受任何手术(图6D-E)。对照组小鼠在 59-75 天达到人道终点,与上述年轻对照组小鼠的终点一致。实验在第二次细胞系注射后 120 天终止(距第一次细胞系注射约 380 天)。CT 加 FOXP3-ASO 的五只长期幸存者小鼠中有四只、三重组合组的七只小鼠中有四只以及 CT 加抗 STAB1 抗体治疗组的三只小鼠中有一只在 380 天内存活,尸检后没有肉眼可见的肿瘤。这表明将 CT 与选择的 Tregs 和/或巨噬细胞靶向相结合可以形成免疫记忆,从而预防或延迟复发。他们观察了再次接受攻击的幸存小鼠网膜中的记忆 T 细胞,发现与年龄匹配的肿瘤对照组相比,CD103 阳性记忆 T 细胞数量众多。
由于 HGSOC 患者在一线治疗后经常复发,他们使用了第三个 HGSOC 同基因小鼠模型 60577,该模型对化疗具有良好的初始反应,但在大约 10 周后自发复发。小鼠对第一次 CT 治疗有反应,治疗后中位生存期为 127 天,而对照组小鼠为 49 天,但复发性疾病的 CT 治疗仅使生存期延长 27 天(图 6F)。与单独使用 CT 相比,使用 CT 加抗 STAB1 抗体治疗复发性 HGSOC 可显著提高生存率。化疗加 FOXP3-ASO +/− 抗 STAB1 抗体治疗明显高于 CT。
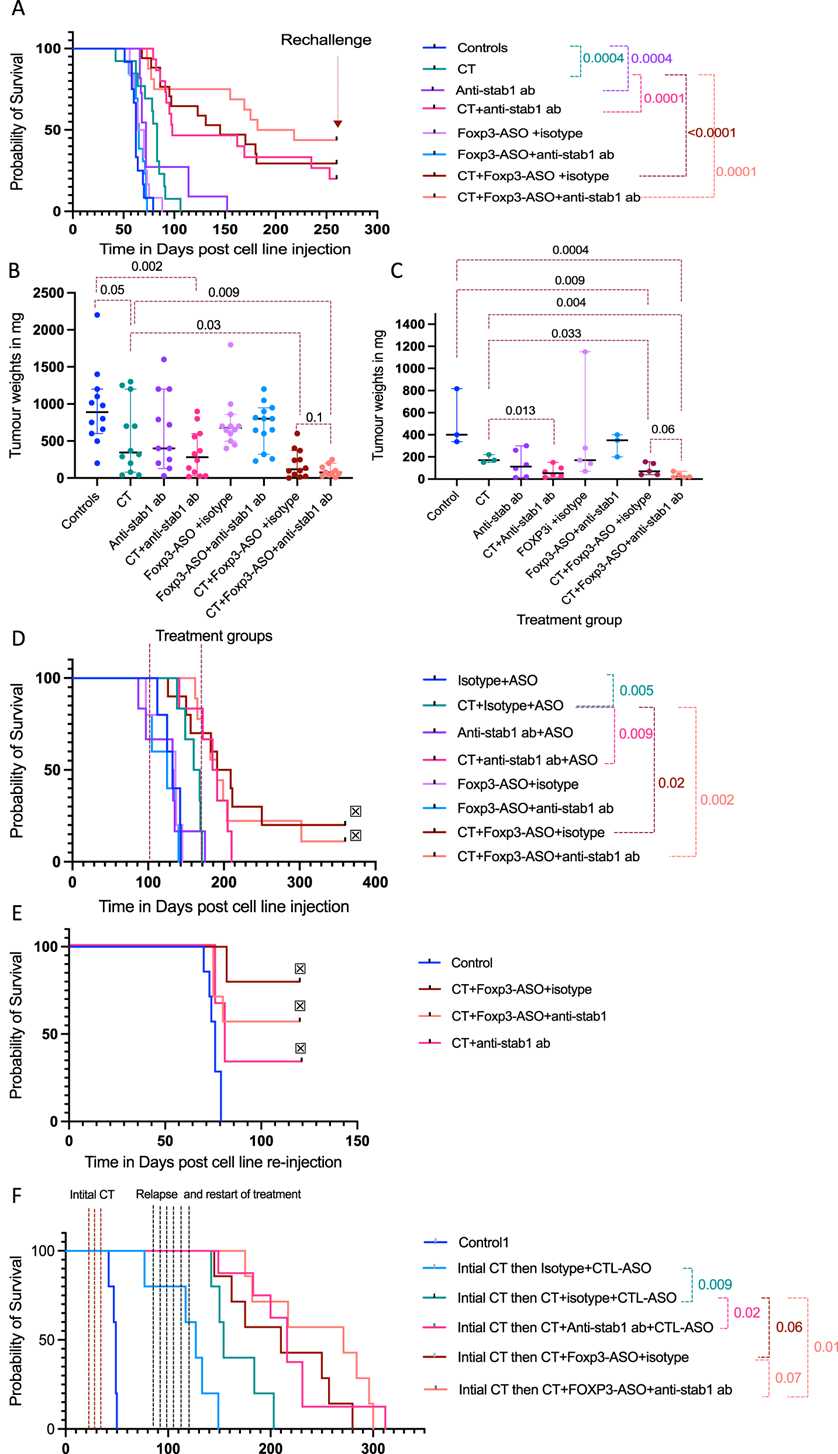
图6. 抗 STAB1 抗体和 FOXP3-ASO 治疗对 HGSOC 小鼠模型生存和复发的影响。
(A) Kaplan-Meier HGS2 模型生存曲线。(B-C)小鼠的肿瘤重量。(D) HGSOC 模型的 Kaplan–Meier 生存曲线。(E-F)生存分析。
07
抗STAB1抗体治疗减少了HGS2模型中的抗原降解并改善了体内抗原呈递
为了了解上述每种药物组合的效果,他们对图6C中实验中的肿瘤进行了RNA-seq。与对照组相比,CT 显著上调了S100a8/9、Fcna、Ctsd、Ctsb、Ctsl、Cxcl2和Mertk,表明单核细胞募集和吞噬作用增强。然而,CT 显著上调了Trem2,这是免疫抑制巨噬细胞的特征。与对照组相比,抗STAB1抗体单一疗法治疗导致抗原呈递途径、TCR信号传导和同种异体移植排斥显著上调。抗 STAB1 与 CT 的结合导致吞噬体和溶酶体组装、酸化和成熟途径下调,从而导致抗原降解减少和抗原呈递改善(图 7A),其中用抗 STAB1 抗体阻断 STAB1 受体不会减少死亡癌细胞的吞噬作用,但会延迟抗原降解。
与对照组相比,FOXP3-ASO 抗体单药治疗可显著上调免疫激活途径。此外,与 CT 联合使用时,与 CT 相比,可显著激活免疫通路(图 7B)。与单独使用 CT 或与抗 STAB1 抗体或 FOXP3-ASO 联合使用相比,三联疗法可显著提高免疫激活途径水平(图 7B-C)。
最后,使用 IHC 他们发现肿瘤和脾脏中所有 FOXP3-ASO 治疗组中 FOXP3 表达细胞的数量显著减少(图 7D-E),而肿瘤中 TBET 表达细胞的数量增加(图 7E)。CT 加 FOXP3-ASO 和三联疗法中 T 细胞和 B 细胞的浸润也显著增加。与化疗相比,联合治疗组的巨噬细胞数量没有显著变化,但 CD11C 表达抗原呈递细胞的数量显著增加(图 7E)。
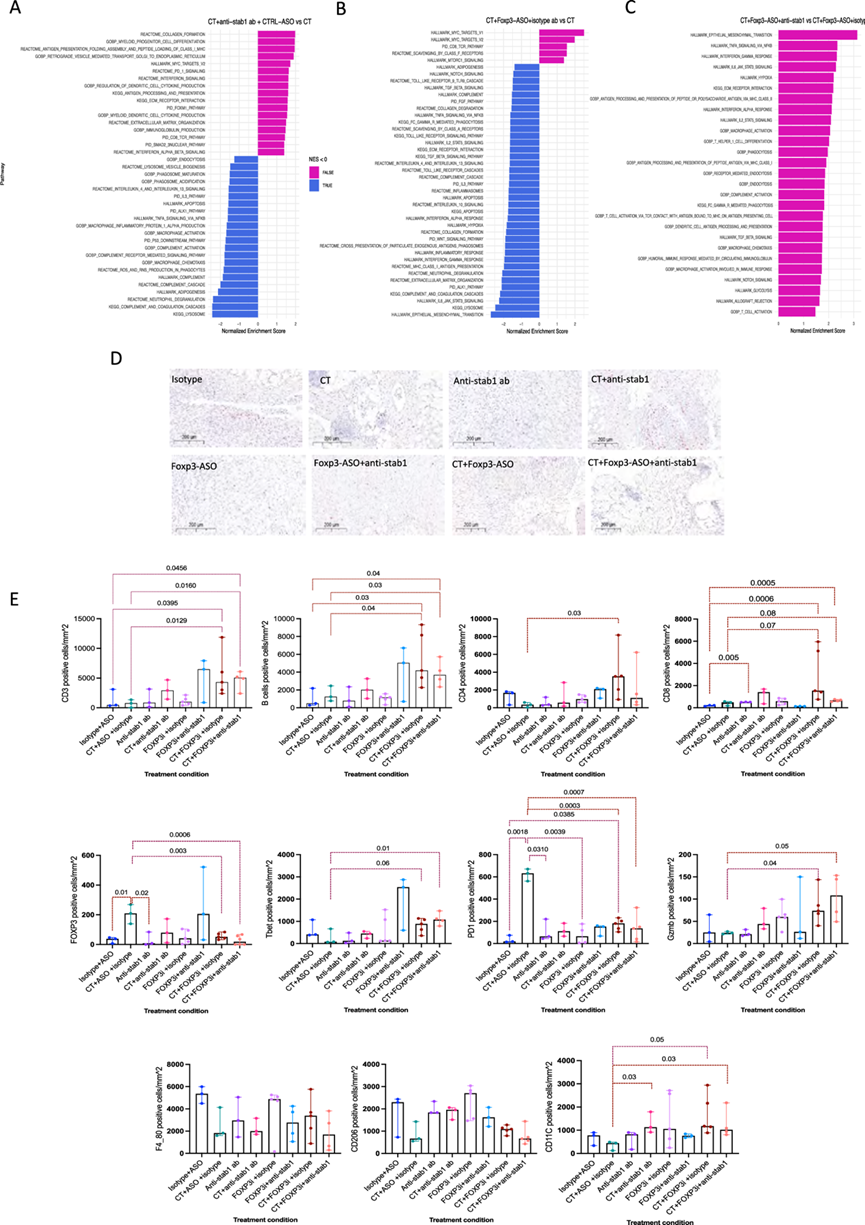
图7. 不同治疗组合对小鼠HGS2网膜肿瘤的影响。
(A-C)差异富集通路分析。(D) HGS2 小鼠网膜肿瘤中FOXP3 染色的代表性 IHC 图像。(E) 每mm2免疫浸润阳性细胞数。
+ + + + + + + + + + +
结 论
本研究对 64097 个细胞的分析确定了 NACT 诱导的巨噬细胞中稳定蛋白-1 (clever-1) 和 Tregs 中 FOXP3 蛋白的过度表达,这在蛋白质水平上得到了证实。体外 STAB1 抑制可诱导抗肿瘤巨噬细胞。FOXP3-ASO将 Tregs 重新极化为效应 T 细胞表型。对来自 HGSOC 同源小鼠模型的 69781 个细胞进行的 scRNA-seq 重现了患者的数据。将化疗与抗稳定素 1 抗体和/或 FOXP3-ASO 相结合,可显著提高两种 HGSOC 同源模型中已确诊腹膜疾病小鼠的生存率,以及第三种模型中的无进展生存率。长期生存者(300 天以上)对肿瘤再次攻击具有抵抗力。抗稳定素 1 抗体使肿瘤富含 CXCL9+ 巨噬细胞,而 FOXP3-ASO 可增加 TBET 细胞浸润。结果表明,针对免疫细胞中的这些分子可能会改善患者的化疗反应。
+ + + + +



 English
English


