NC |顶尖科研团队首次系统揭示FADS在肝癌铁死亡 抵抗与CD8+ T细胞招募抑制中的双重作用
NC |顶尖科研团队首次系统揭示FADS在肝癌铁死亡抵抗与CD8+ T细胞招募抑制中的双重作用
10月29日,《Nature Communications》(IF=15.7)在线发表由南京医科大学、中国医学科学院等顶尖科研团队联合完成的重磅研究成果“ FAD synthase confers ferroptosis resistance and restrains CD8+ T cell recruitment in hepatocellular carcinoma ”。研究首次系统揭示了FADS在肝癌铁死亡抵抗与CD8+ T细胞招募抑制中的双重作用,为肝癌免疫治疗提供了全新靶点。
开泰生物为本研究提供了单细胞RNA测序等关键技术服务,项目案例再+1!感谢每一位科研伙伴的信任与协作,开泰将继续努力,提供更优质的服务!

研究背景
肝细胞癌(HCC)是全球范围内最普遍、最致命的恶性肿瘤之一,超过一半的病例在晚期才被诊断。尽管酪氨酸激酶抑制剂、抗血管生成疗法和免疫检查点抑制剂为HCC患者提供了生存获益,但耐药性经常发生,导致临床结果不尽人意。因此,迫切需要改进HCC的治疗策略。
代谢重编程是癌症的一个标志,了解失调的代谢如何促进肿瘤进展成为研究的热点。然而大多数研究集中在主要代谢途径的失调上,维生素代谢在肿瘤进展和治疗抵抗中的作用还有待进一步探索。
研究内容及结果
HCC细胞表现出VB2代谢的激活
研究团队首先对三个HCC数据集进行分析,基于Reactome数据库定义一个VB2代谢特征基因集(SLC52A1, SLC52A2, SLC52A3, RFK, FLAD1, ACP5, 和 ENPP1),计算VB2代谢评分,据此量化代谢激活水平。与邻近肝组织相比,肿瘤中的VB2代谢评分显著更高(图1a),表明VB2代谢在HCC中明显活跃,并且具有较高VB2代谢评分的患者表现出较差的预后(图1b)。
为评估TME内不同细胞群中的VB2代谢水平,研究人员对来自免疫治疗队列的HCC活检样本做单细胞RNA测序,获得81,250个高质量细胞鉴定出七种主要细胞类型(图1c, d)。并使用InferCNV算法从上皮细胞鉴定出18,642个恶性肿瘤细胞,且肿瘤细胞拥有最高的VB2代谢评分,显著高于正常上皮细胞(图1e)。来自公共数据库的scRNA-seq数据(GSE202642)也验证了这一发现(图1f, g),随后研究团队将分析重点放在肿瘤细胞上。
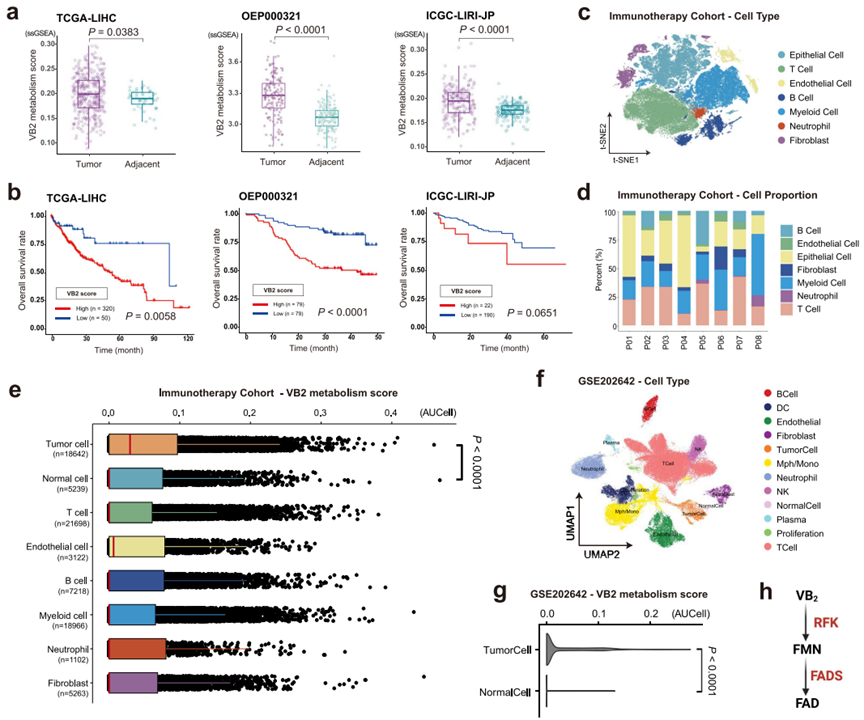
图1. VB2代谢促进HCC进展
VB2代谢促进HCC细胞的恶性行为
究团队接下来从代谢物和酶的角度分析VB2代谢对HCC细胞的影响(图1h)。通过细胞迁移实验、构建体外模型、敲降、过表达等实验验证VB2代谢在支持HCC细胞的恶性行为中起着关键作用。分析发现FADS在人类HCC中广泛过表达,高FLAD1表达与HCC患者对PD-1治疗抵抗和较差的预后相关。
FADS促进HCC细胞生长并抑制T细胞介导的抗肿瘤免疫力
为研究FADS在HCC进展中的作用,研究团队使用Fads敲低(shFlad1)的Hepa1-6细胞,在免疫正常的C57BL/6小鼠中建立肿瘤模型,观察发现Fads敲低显著抑制肿瘤生长。考虑到肿瘤免疫的捕食者-猎物理论,肿瘤消退可能源于肿瘤细胞脆弱性增加和抗肿瘤免疫力增强。鉴于T细胞,特别是CD8+T细胞,在抗肿瘤免疫中的关键作用,推测T细胞可能有助于肿瘤消退。
研究人员分别在免疫正常小鼠C57BL/6和免疫缺陷小鼠Rag1−/−(缺乏T和B细胞)中生成肿瘤模型,观察肿瘤消-长情况,证实T细胞在介导肿瘤消退中的重要性。鉴于巨噬细胞在肿瘤中的普遍存在,研究团队也通过施用氯膦酸盐脂质体进行巨噬细胞耗竭实验,证实巨噬细胞并未参与FADS敲低诱导的肿瘤消退。
综上所述,FADS通过支持肿瘤细胞生长和抑制T细胞介导的抗肿瘤免疫力来促进HCC进展。
单细胞转录组分析揭示FADS对肿瘤微环境的影响
为全面描述FADS对TME的影响,特别是对肿瘤细胞和T细胞的影响,研究人员使用Hepa1-6细胞在C57BL/6小鼠中建立原位肿瘤,第14天收获肿瘤进行scRNA-seq(图3a)。10个样本(5个FADS敲低肿瘤 [KD] 和5个对照肿瘤 [NC])进行单细胞测序,捕获128,884个细胞用于下游分析。无监督聚类识别出29个不同的细胞簇,利用Marker基因鉴定为15种细胞类型(图3b),同时也鉴定了恶性肿瘤细胞。
接下来重点分析肿瘤细胞,scDist分析显示,肿瘤细胞在FADS敲落后表现出最显著的扰动(图3c)。与对照相比,Fads敲低模型中肿瘤细胞Flad1表达和VB2代谢评分都更低(图3d),表明FADS的缺失损害了VB2代谢活性。差异基因KEGG富集分析显示,肿瘤细胞代谢途径显著改变,包括葡萄糖、脂质和氨基酸代谢,以及免疫相关途径;与细胞铁死亡相关途径也被富集(图3e)。
接下来研究团队又将注意力转向T细胞,对T和NK淋巴细胞重新聚类,分出16个亚群,从中鉴定出7个不同的CD8+T细胞群(图3f),分析发现其中6个(C11, C06, C05, C03, C02, C01)表现出显著的T细胞耗竭特征(图3g)。表明肿瘤内CD8+T细胞大部分处于耗竭状态,这与人类HCC的观察结果一致。FADS敲落后,CD8+T细胞亚群出现明显的扰动(图3h)。使用干扰素、功能障碍和增殖的基因特征评估CD8+T细胞功能。发现与对照相比,FADS敲低模型中几乎所有CD8+T细胞亚群都表现出改善的细胞毒性、减少的耗竭和增强的增殖(图3i)。差异基因富集分析显示,CD8+T细胞配体-受体信号传导、T细胞活化、趋化因子、细胞因子和细胞内信号转导上调(图3j)。
总之,FADS对TME内肿瘤细胞和CD8+T细胞都产生较大影响,而FADS的缺失重塑了免疫抑制性TME。
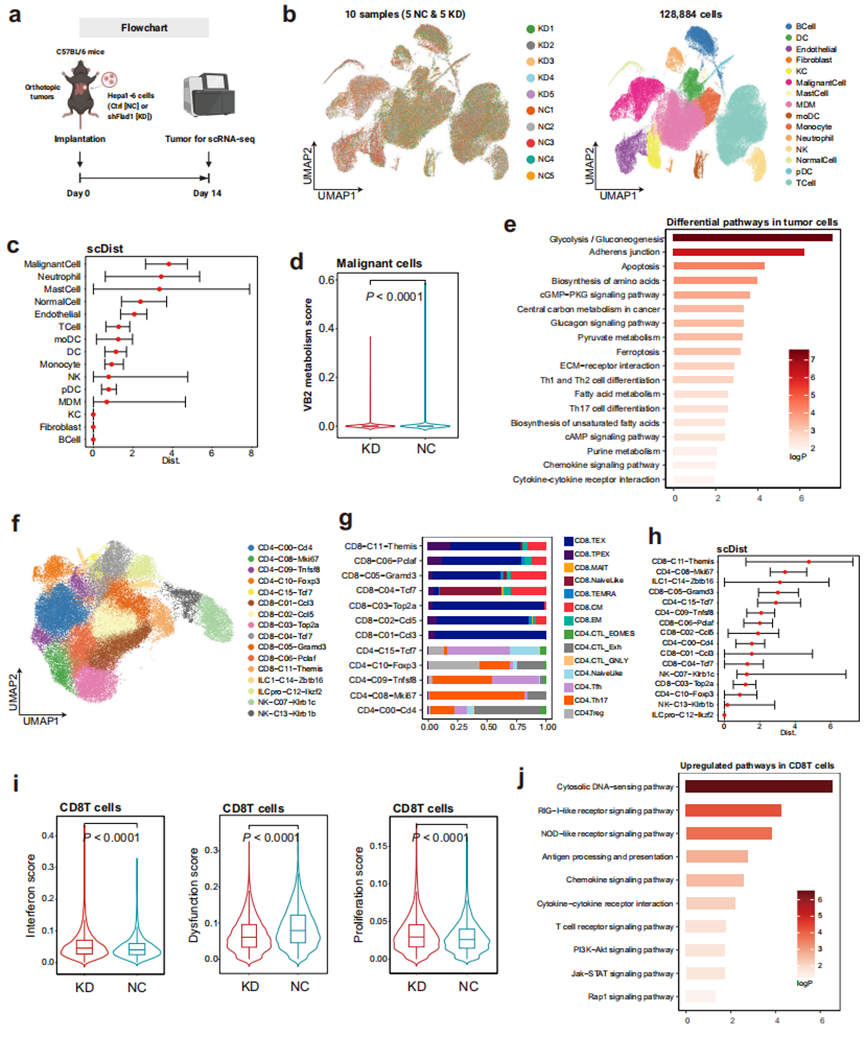
图3. 单细胞RNA测序分析揭示FADS对肿瘤微环境的影响
FADS敲低增加CD8+T细胞浸润
为研究肿瘤细胞FADS如何影响CD8+T细胞,研究人员将注意力集中到scRNA-seq分析挖掘到的趋化因子信号通路,其在肿瘤细胞和CD8+T细胞中都显著富集(图3e, j)。利用普通转录组测序分析,证实趋化因子受体结合趋化因子通路在FADS敲低细胞中显著上调,表明FADS可能通过趋化因子信号调节CD8+T细胞的募集。
接着研究团队又利用公共数据集,组织微阵列分析,流式细胞术等,证实FADS在HCC中抑制CD8+T细胞的募集,敲低FADS增加CD8+T细胞浸润。并依据转录组分析结果,推导调节机制:FADS可能通过抑制cGAS-STING通路的激活及下游趋化因子的表达,从而减轻活性氧(ROS)引发的DNA损伤,以阻碍CD8+T细胞募集。单细胞数据数据分析结果也支持这一推论,γH2AX染色评估DNA损伤实验、蛋白质印迹分析也分别验证了该调节机制。
FADS敲低触发HCC细胞铁死亡
FADS的缺失抑制了HCC细胞的生长,其潜在机制需要进一步研究。单细胞RNA测序分析表明,FADS基因敲低的肿瘤细胞中,与细胞死亡相关的代谢通路显著富集(图3e)。值得注意的是,在FADS敲低HCC细胞中观察到明显的细胞死亡,伴有细胞膜破裂(图5a)。为进一步解析代谢变化,研究团队对FADS敲低的Hep3B细胞进行非靶向代谢组学分析。结果显示,FADS敲低导致VB2水平增加,FAD水平降低,FMN水平无显著变化(图5b)。KEGG富集分析显示,谷胱甘肽代谢和多种脂质代谢途径,包括不饱和脂肪酸的生物合成和花生四烯酸代谢,发生显著改变(图5c)。具体来说,FADS敲低导致促铁死亡的多不饱和脂肪酸及其脂质过氧化产物12(S)-HETE的水平升高(图5d)。谷胱甘肽是主要的抗氧化剂,其水平在FADS敲低细胞中降低(图5e)。此外,在FADS敲低细胞中,脂质过氧化显著增加(图5f, g)。用铁死亡抑制剂Ferrostatin-1处理挽救了FADS敲低引起的细胞死亡,而用铁死亡诱导剂Erastin处理则消除了FADS过表达提供的保护作用(图5g)。这些结果表明FADS促进了细胞对铁死亡的抵抗,其缺失会诱导铁死亡。
为确定这些发现是否是HCC中特异的,研究团队在乳腺癌细胞系MDA-MB-468和肺癌细胞系A549中也进行了相关实验,发现结果与在HCC细胞中一致,说明FADS在癌症研究中具有更广泛的意义。
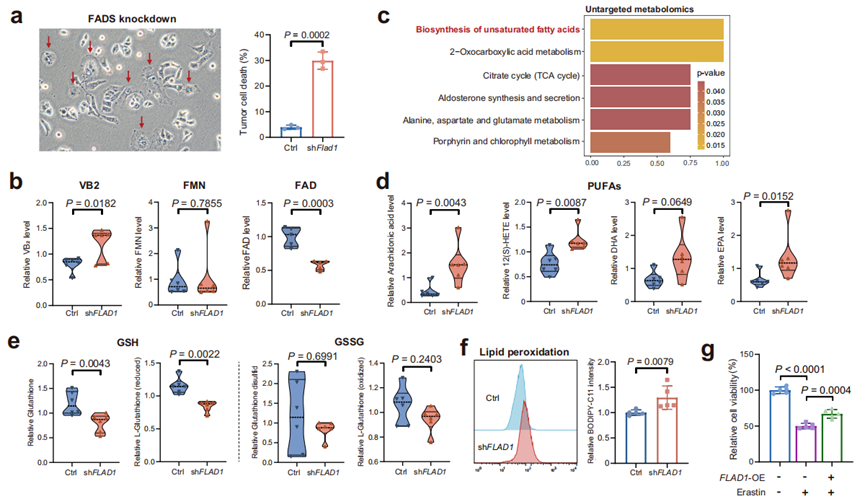
图5. FADS生成FAD抑制铁死亡
随后,研究团队又通过大量分子实验,证实FADS赋予肿瘤细胞铁死亡抗性。具体机制包括:1)FADS通过其在FAD产生中的酶作用赋予HCC细胞铁死亡抗性;2)FADS通过与PCBP2相互作用抑制铁死亡;3)FADS招募USP10去泛素化并稳定PCBP2,从而维持细胞内二价铁离子稳态并阻止铁死亡。
橙皮苷被鉴定为潜在的FADS抑制剂
目前,尚无可用的FADS抑制剂。为解决这一空白,研究团队进行了基于结构的高通量虚拟筛选,使用ChemDiv数据库(1,583,358种化合物)来搜索潜在的FADS抑制剂(图7a)。结合口袋设置在FADS C末端,包含酶催化中心。经过三轮筛选并应用对接得分大于10为阈值,将选择范围缩小到26个排名靠前的化合物。其中,五种商业可用且可大规模生产的化合物,被选作实验验证(图7b)。其中,橙皮苷在抑制细胞增殖方面表现出最有效的效果(图7c, d),临床上,橙皮苷也是已批准药物产品中的活性成分。
橙皮苷对HCC细胞增殖的抑制作用通过集落形成实验得到证实(图7e)。在皮下模型中,与对照组相比,橙皮苷治疗在Rag1-/-小鼠中显著抑制肿瘤生长,减少肿瘤重量(图7f),在C57BL/6小鼠中效果更强(图7g)。橙皮苷治疗还导致C57BL/6小鼠肿瘤内CD8+ T细胞浸润增加(图7l),并且通过组织病理学和血清生化分析表明未出现器官毒性迹象。
一系列实验证明橙皮苷诱导的铁死亡是通过抑制FADS介导的,显示出橙皮苷强大的抗肿瘤效果,突出了其作为HCC治疗候选物的潜力。
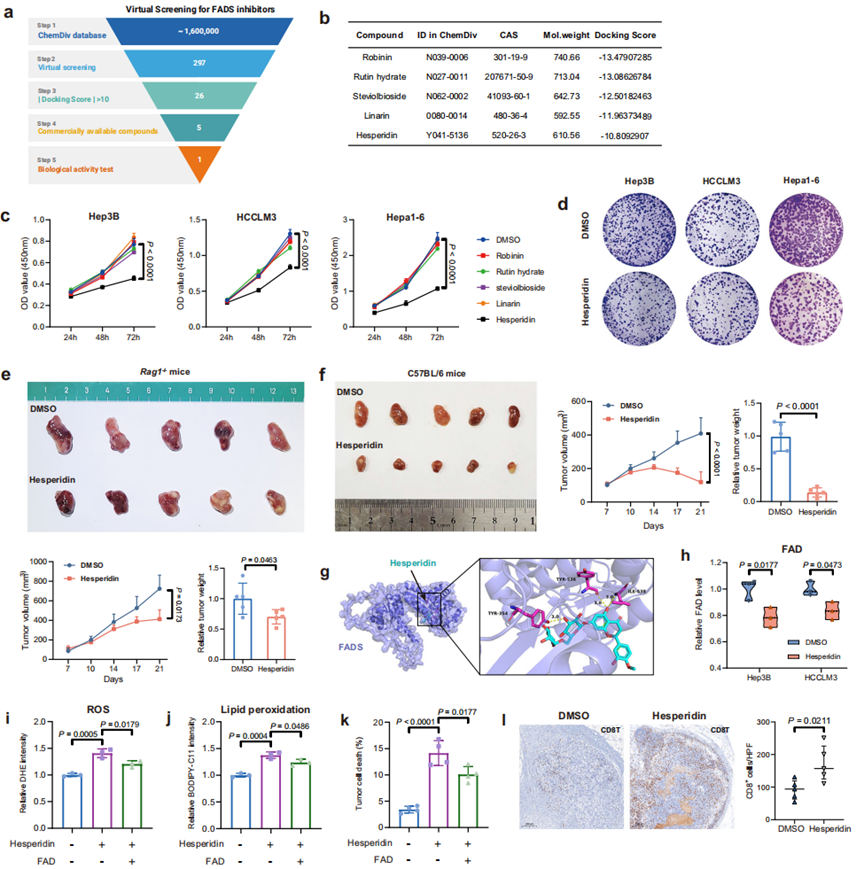
图7. 橙皮苷被鉴定为FADS抑制剂
讨论与总结
之前几项流行病学研究探讨了VB2与癌症之间的关系,表明VB2代谢在不同癌症中具有复杂的、背景依赖性的作用,而本研究证明VB2代谢促进HCC进展。RFK和FADS是VB2代谢中的关键酶,在正常组织中RFK被认为是限速酶,然而,本研究数据显示,在HCC中广泛过表达的是FADS,而非RFK,这使FADS成为HCC中VB2代谢的主导者。为挖掘治疗潜力,本研究还筛选确定了橙皮苷作为一种潜在的FADS抑制剂,但目前尚缺乏其关于癌症患者治疗的临床数据,需要进一步研究。
总之,FADS通过两个主要机制促进HCC进展(图8):(i) 促进肿瘤细胞中铁死亡抗性以支持肿瘤生长; (ii) 抑制CD8+T细胞的募集,从而抑制抗肿瘤免疫力。本研究证实FADS是HCC中一个有前景的治疗靶点。
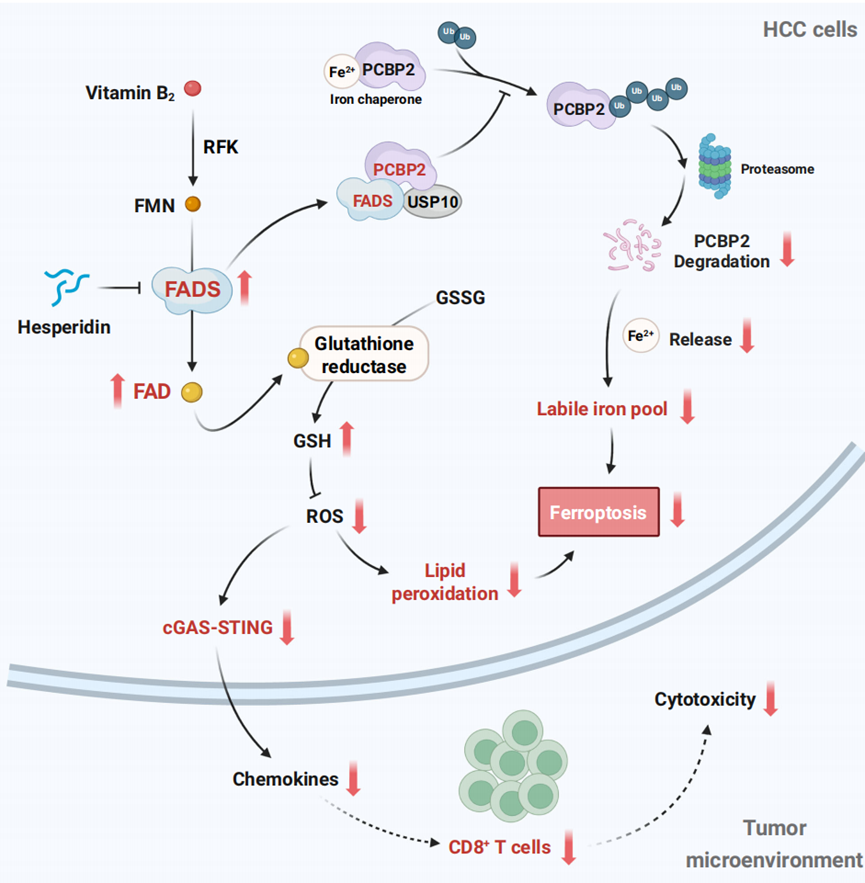
图8. VB2代谢与FADS在HCC进展中的作用机制解析
获取原文:https://doi.org/10.1038/s41467-025-64572-y
关于开泰生物
亚洲熟妇无码乱子AV电影-日韩av第一区免费-人妻无码综合麻豆-玩弄JAPAN白嫩少妇HD小说-吻胸揉屁股摸腿娇喘视频网站成立于2006年,是集研发、生产、销售、客户服务为一体的生物类高新技术企业;长期致力于为广大客户提供生命科学研究的整体解决方案。
开泰的产品线包括单细胞转录组测序、单细胞多组学测序、空间转录组测序、空间蛋白组测定等单细胞时空组;ATAC-seq、ChIP-seq、m6A(MeRIP seq)、全基因组甲基化等表观组学;Ribo-seq、转录组、基因组、蛋白和代谢等科研服务。产品广泛应用于生命科学、医学、农业-分子育种、制药、环境等领域的基础研究。客户遍布大学、研究所、医院、检验所、血站、出入境检验检疫等单位。在中国大陆大部分省市都设有自己的分公司或办事处。
开泰单细胞产品优势
1、千例样本炼就“解离超能力”,被称为“疑难组织克星”!
✅ 胰腺、肝脏、肾脏 ✅ 肠道、卵巢、动脉
✅ 脑组织、心肌、肌肉 ✅ 椎间髓核、颅骨、昆虫
✅ 植物组织及各类疑难组织
2、双平台火力全开,成本直降50%!
双平台:10X Genomics(主流)+ 华大智造DNBelab C(国产性价比之王)。
开泰更是以高难度样本水稻茎-叶鞘的单细胞测序数据通过华大智造的服务商认证,成为DNBelab C系列高通量单细胞RNA文库制备服务商。

3、开泰从样本到发文“全流程护航”!
免费解离测试 → 个性化生信分析 → 顶刊级图表输出
联系我们



 English
English

