文献解读|Cancer Cell(44.5):空间蛋白质转录组分析揭示了边缘性卵巢肿瘤的分子景观及其侵袭性进展
✦ +
+
论文ID
原名:Spatial proteo-transcriptomic profiling reveals the molecular landscape of borderline ovarian tumors and their invasive progression
译名:空间蛋白质转录组分析揭示了边缘性卵巢肿瘤的分子景观及其侵袭性进展
期刊:Cancer Cell
影响因子:44.5
发表时间:2025.06.20
DOI号:10.1016/j.ccell.2025.06.004.
背 景
浆液性卵巢肿瘤是最常见的卵巢癌。它们分为高级别卵巢癌 (HGSC) 和低级别卵巢癌 (LGSC),后者仅表现出轻微的异形性和少量的有丝分裂特征。LGSC 患者通常比 HGSC 患者(中位年龄 62 岁)更年轻(中位年龄 45 岁),且生长较慢,肿瘤浸润广泛,周围有致密的纤维化基质和深层浸润,因此难以通过手术完全切除。如果在初次手术时无法完全切除肿瘤,转移性 LGSC 的临床病程较为缓慢,复发率较高,治愈率较低。虽然 LGSC 是不同的疾病类型,但其治疗采用与 HGSC 相同的标准铂类/紫杉烷类化疗。然而,对于 LGSC 来说,这种治疗通常会导致较低的临床反应率和持续缓慢的进展。虽然基因变异提示其共同起源,但从 SBT 到 LGSC 的转变机制仍知之甚少。
实验设计
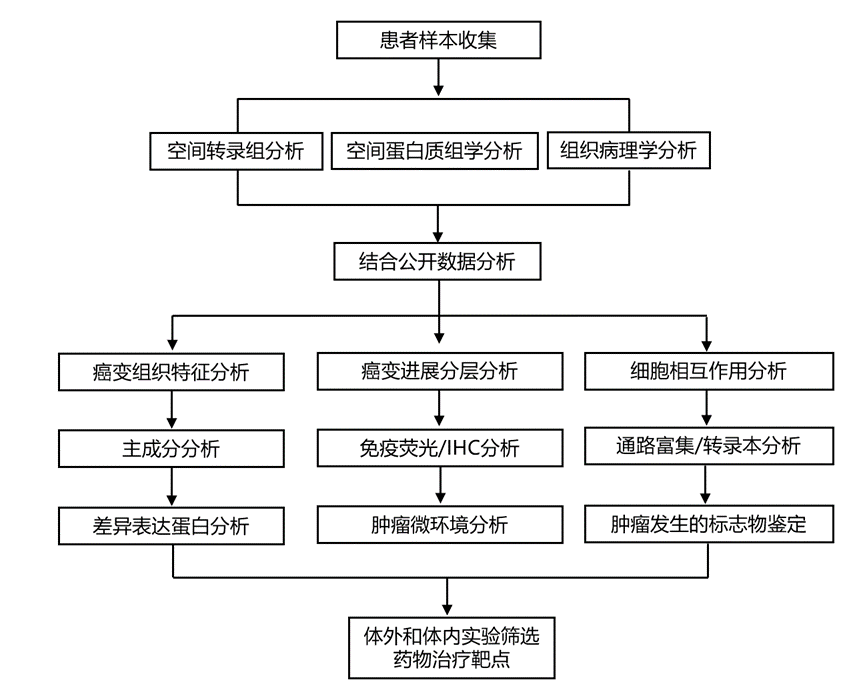
结 果
01
交界性肿瘤向低级别浆液性癌转变的空间多组学
研究团队使用空间组学技术和来自浆液性交界性肿瘤 (SBT)、微乳头状 SBT (SBT-MP) 和原发性LGSC (LGSC-PT) 及其相应转移瘤 (LGSC-Met) 患者的代表性组织学病例,研究 SBT 通过假定的中间步骤恶性转化为侵袭性和转移性 LGSC 的过程。SBT进展为微乳头状 SBT (SBT-MP),最终进展为 LGSC,如果不及早诊断和治疗,则可能会发生转移(图 1 A)。他们采用空间蛋白质组学 (DVP) 和转录组学 (GeoMX) 技术分析了一个发现队列,该队列包括 4 例 SBT 患者、4 例 SBT-MP 患者、3 例原发性 LGSC-PT 和患者匹配LGSC-Met组织样本,以隔室分辨方式表征这种进展过程(图 1 B)。对于每位患者,他们以细胞类型分辨的方式在每个组织切片的至少三个不同的感兴趣区域 (ROI) 中研究了上皮肿瘤和基质区室。
深度可视化蛋白质组学技术 (DVP) 是首个能够对不同细胞类型进行区室分辨蛋白质组学分析同时保留其空间坐标的方法,从而能够与空间转录组学进行比较。对于 DVP,他们使用上皮细胞 (EPCAM) 和基质细胞 (decorin) 的标记物进行免疫荧光染色(图 1 C)。DVP的独特优势在于它能够记录和保存组织结构中每个细胞的形态特征。
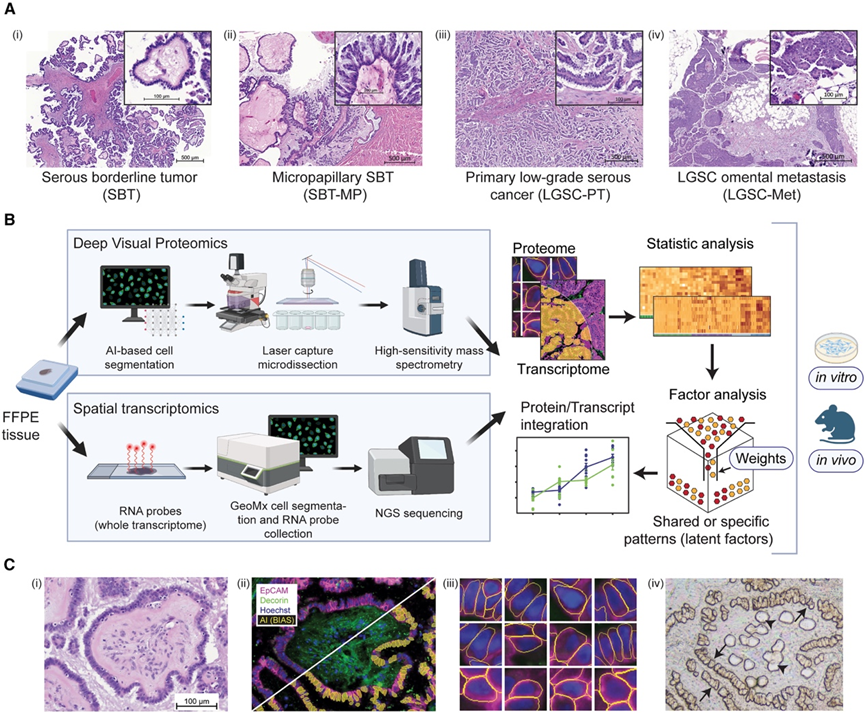
图1. 浆液性交界性癌和低级别卵巢癌的特征。
(A)代表性H&E图像。(B) 结合生物信息学和多组学整合 (MOFA+) 的实验流程,用于鉴定潜在治疗靶点并进行功能验证。(C) DVP 中的基于人工智能的细胞识别和激光解剖。
02
深度视觉蛋白质组学分析揭示了边缘性肿瘤向转移性低级别浆液性癌的进展
使用来自上皮区空间蛋白质组学的数据进行主成分分析 (PCA),对所有四种组织学(SBT、SBT-MP、LGSC-PT 和 LGSC-Met)进行分层。微乳头生长是非侵袭性浆液性边界线和侵袭性 LGSC 之间的中间阶段(图 2 A)。线性回归显示 195 种蛋白质在侵袭性表型中发生显著改变,包括脂肪生成调节因子 ADIRF,它与顺铂耐药性相关,这195种蛋白质标志着从 SBT 到 LGSC 及其相应转移的转变。
在 SBT 或均匀的 SBT-MP 背景中具有微乳头特征的 SBT 复发为 LGSC 的风险高于传统 SBT。然而,SBT-MP(图 1 A)是否是 LGSC 的前体仍存在争议。SBT 和 SBT-MP 之间最显著的变化涉及代谢变化,特别是精氨酸生物合成通路中的关键酶精氨琥珀酸合酶 (ASS1) 的丰度变化,以及 ALDH6A1 和 ALDH2。几种蛋白质在 SBT 和 SBT-MP 之间发生了显著变化,这是假设转变的第一步,但在 LGSC 及其相应的转移中保持了其丰度。转录因子 AHDC1 和 ERF 以及干性相关蛋白 AQP5 和 ASB6 在 SBT-MP 中上调,但在 LGSC 及其转移瘤中保持稳定。肿瘤抑制因子 CDKN2A在 SBT-MP 中下调,在 LGSC 和 LGSC-Met 中保持低水平。虽然 SBT-MP 蛋白质组学谱与 SBT 比与 LGSC 更相似,但它们在视觉上显示出恶性转化的标志,例如微乳头组织结构,这与 SBT/SBT-MP 在 PCA 中的共定位一致(图 2 A)。比较上皮区室中的 SBT 和 LGSC-PT,鉴定出 963 个差异表达蛋白。上调的蛋白包括 SHMT1 和 TAGLN,此前已发现它们与 HGSOC 相关(图 2 B)。LGSC 及其转移瘤中 ZMYND10 和 OSCP1/NOR1(两种参与表观遗传调控的抑癌基因)以及前梯度蛋白 2/3 (AGR2/3) 逐渐丢失,此前已发现 AGR2/ 3与 SBT 进展为 LGSC 有关。
超过 50% 的 LGSC 和 60% 的 SBT 中 MAPK 信号通路发生改变。与交界性肿瘤相比,LGSC 显示致癌 MAPK 通路的几个成员富集(图2 C)。KRAS、SRC、MAPK3(ERK1)、MAP2K2(MEK2)和转录抑制因子 ERF 从 SBT 到 LGSC 逐渐增加(图 2 C)。虽然在某些情况下存在 KRAS 和 BRAF 突变,但它们并不普遍。TGF-β 通路成分(包括致癌 ADAM17)在 SBT-MP 和 LGSC 中上调,促进 EMT 24和 T 细胞抑制。大多数 SBT 和 LGSC 肿瘤表达雌激素和孕激素受体,其中 PGRMC2 从 SBT 到 SBT-MP 增加,表明孕激素在早期 LGSC 转变中发挥作用(图 2 D)。SBT 表达输卵管分泌细胞标志物 PAX8,以及纤毛细胞蛋白(CAPS、TPPP3 和 NUDC),这些蛋白在进展为 LGSC 后缺失。在 LGSC 中,免疫荧光证实纤毛细胞分布稀疏(图 S3 F),并与凋亡蛋白(包括 FADD、CASP-3/8 和 TRADD)表达降低相关(图 2 E)。
他们发现了剪接调节因子 NOVA2 的特异性表达,该蛋白通常在大脑中表达,而在健康卵巢组织中不表达(图 2F-G),且通过免疫组织化学(IHC)实验证实了 NOVA2 的表达(图2H),并注意到其差异表达仅在蛋白质组水平而非转录组水平明显。当比较 SBT 和 LGSC-PT 时,14.5% 的所有蛋白质显示出显著差异,而相比之下,LGSC-PT和LGSC-Met之间仅有0.3%的蛋白质存在显著差异,这包括转移性上调神经母细胞瘤蛋白 (NENF),这是一种调节神经祖细胞增殖的蛋白质。对个体患者的分析显示,转移瘤和 LGSC 之间存在显著的蛋白质组异质性,每位患者的样本都显示出一组特异性表达的蛋白质,有助于 LGSC-PT 和转移瘤之间的分层(图 2 I),这些变化包括二硫键异构酶 P4HB,它与脑胶质瘤进展有关(图 2 J)。
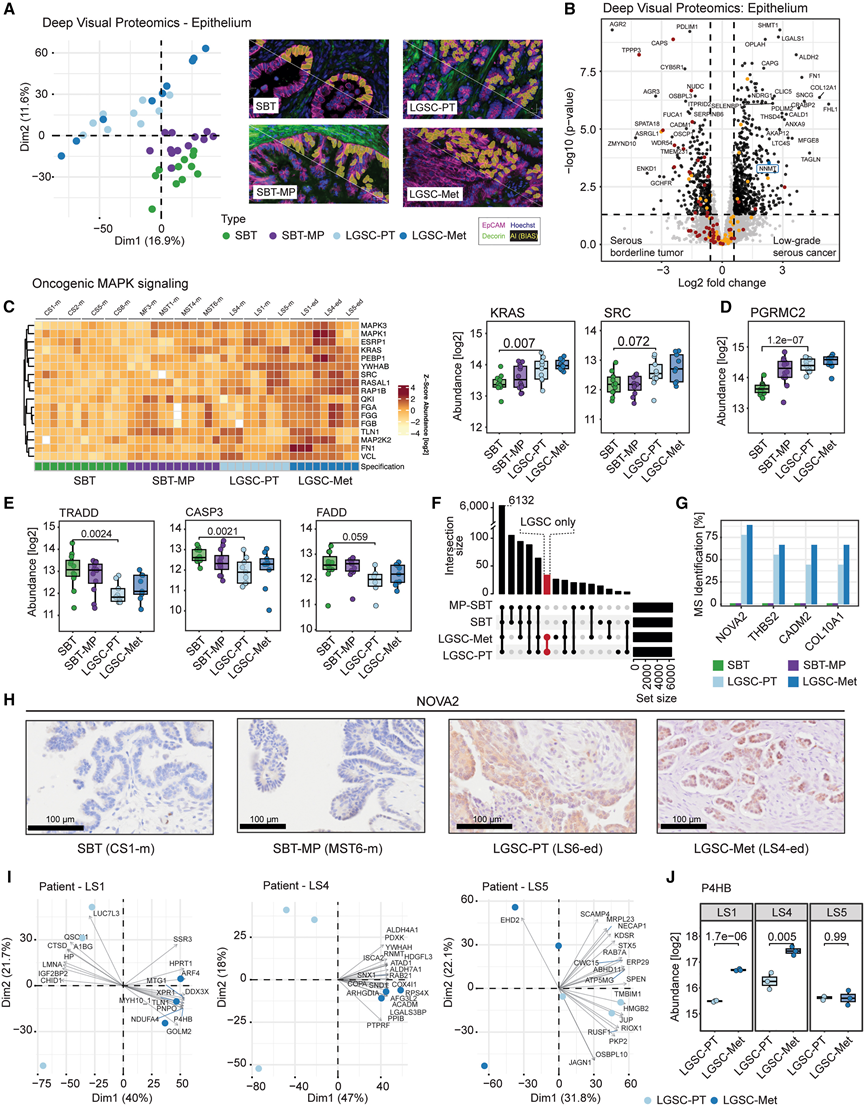
图2. 上皮肿瘤区段的深度可视化蛋白质组学分析。
(A) 上皮的主成分分析 (PCA) 区分了浆液性交界性肿瘤、具有微乳头状结构的浆液性交界性肿瘤、侵袭性低级别浆液性癌以及相应的转移性肿瘤。(B) SBT 和 LGSC-PT 之间上皮的差异表达蛋白的火山图。(C) 热图显示丝裂原活化蛋白激酶 (MAPK) 信号通路蛋白在向 LGSC 及相应转移过程中逐渐增加。(D)四组之间膜相关孕酮受体成分 2 (PGRMC2) 显著变化的箱线图。(E) 从 SBT 到 LGSC-Met,凋亡相关蛋白质的丰度降低。(F) 比较组间特异性蛋白质检测模式的翻转图,该图显示了通过质谱法仅在某些组织学组中检测到的蛋白质。(G) 仅来自 (F) 的 LGSC 蛋白质子集。条形图表示每组中质谱鉴定出四种最常见蛋白质的样本百分比。(H) NOVA2的免疫组织化学染色。(I) 对患有侵袭性肿瘤的个体患者的主成分分析(PCA),对LGSC和相应的转移瘤进行分层。(J) 三分之二的患者中 P4HB 蛋白表达出现显著改变。
03
利用空间蛋白质组学分析肿瘤微环境
DVP 通过基于 AI 的单个细胞类型识别,实现不同组织区室中的蛋白质检测。对核心蛋白聚糖+基质细胞的分析(图 3A)表明,在从 SBT 到 LGSC 的转变过程中,有 178 种蛋白质发生了显著变化。主成分分析显示,与 LGSC 及其转移相比,SBT 和 SBT-MP 中的蛋白质表达模式不同(图 3B),突出了肿瘤侵袭过程中的主要基质变化。与上皮区室(图 2A)不同,SBT-MP 表现出中间特征,SBT 和 SBT-MP 的基质谱保持相似,表明早期 SBT-MP 变化起源于上皮细胞。最明显的基质蛋白表达发生在从 SBT 到 LGSC 的转变过程中(629 个差异表达蛋白),包括 ANXA2 及其调节因子 S100A10 的上调,它们在癌细胞增殖和侵袭中起着核心作用(图 3C)。LGSC-PT 中上调的主要生物学过程涉及细胞骨架动力学;他们发现肌动蛋白 (ACTG1) 及其中心调节因子 ROCK2以及细胞骨架组织的其他成分(ARPC2-4、CFL1、ITSN1 和 PAK1/2)上调,所有这些都与 Ephrin 信号传导有关。
他们发现侵袭性 LGSC 中细胞间粘附蛋白丰富度增加,包括凋亡抑制因子 COMP 和 GAS6,这与上皮细胞凋亡减少一致(图 2 E)。对相互作用配体的进一步分析表明,LGSC-PT 中上调的配体和受体比 SBT 更多(图 3 D),例如上皮 MMP14 与其基质受体 SDC1(已知的侵袭驱动因素)之间的相互作用。基质细胞上的 α5β1-整合素(ITGA5、ITGB1)受体及其配体纤连蛋白(FN1)在两种细胞类型中的表达量都很高,在进展为 LGSC-PT(图 3 E)和转移性上皮细胞的过程中增加,他们利用 IHC 验证了发现队列和验证队列中 β1-整合素和纤连蛋白的高表达。细胞类型特异性相互作用的分析表明,基质-基质相互作用主要由整合素(ITGA5、ITGAV 和 ITGA11)和血小板反应蛋白(THBS3 和 THBS2)介导(图 S8 D)。在上皮-上皮相互作用的分析中,他们发现了与 APP 和 ICAM1 相互作用的金属蛋白酶 ADAM17,以及与层粘连蛋白(LAMC1、LAMA3 和 LAMB3)相互作用的神经元蛋白 PRNP(CD230)。MMP2 及其调节因子 TIMP3 均在肿瘤进展过程中在肿瘤微环境中表现出上调(图 3 G)。他们确定了 CD147(BSG),它促进肿瘤细胞分泌 MMP 囊泡,并早在 SBT-MP 35时就在上皮区室中表现出上调(图 3 H)。从非侵袭性肿瘤阶段到侵袭性肿瘤阶段的基质转变以葡萄糖代谢增加为特征,包括限速糖异生酶FBP1和PCK2/PEPCK 36的上调(图3I)。NNMT是一种成纤维细胞代谢调节剂,此前已证实其能够控制从正常成纤维细胞到癌症相关成纤维细胞(CAF)的转变,是侵袭性LGSC基质和上皮中上调最显著的蛋白质之一(图3 J)。
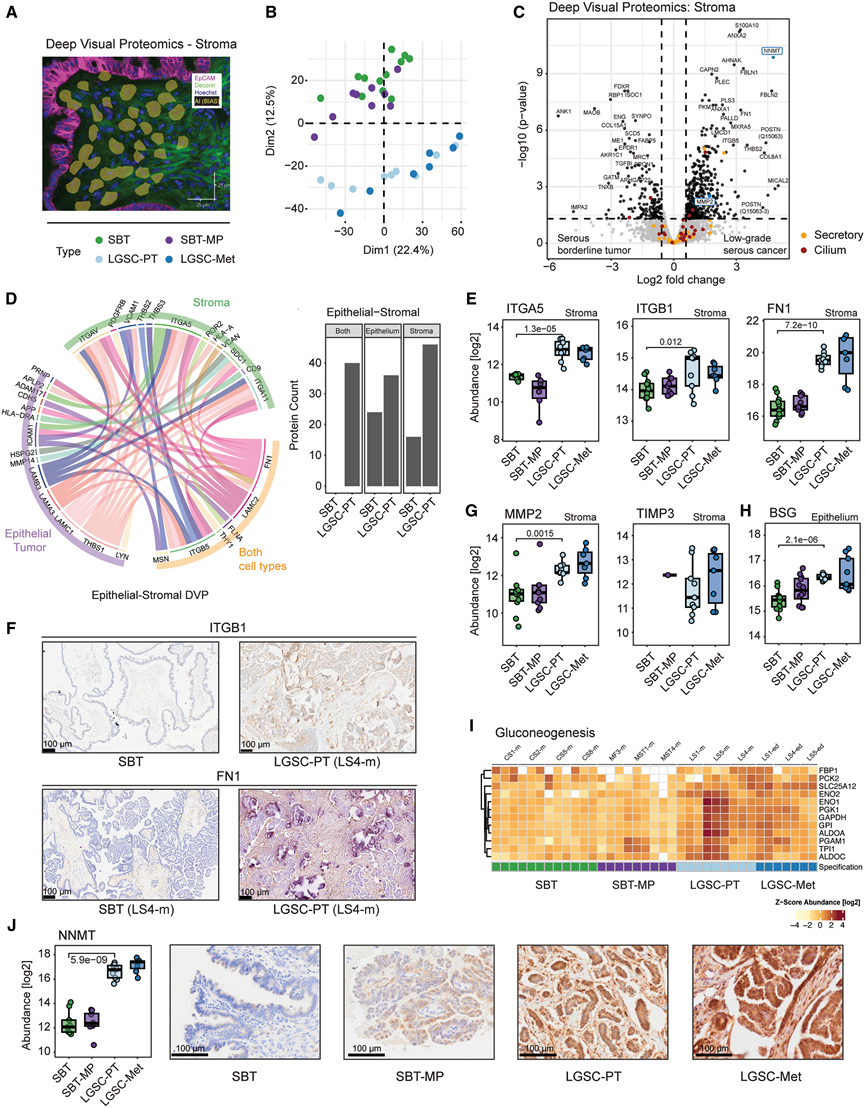
图3. 基质区室的深度可视化蛋白质组学揭示了 SBT 向 LGST 转变的双模态性。
(A) 免疫荧光勾画出从基质中提取细胞等价物的图像。(B) PCA比较基质蛋白表达,显示浆液性交界性肿瘤和微乳头状肿瘤与侵袭性低级别浆液性癌及其相应的转移瘤分离。(C) 基质区中 SBT 和 LGSC-PT 之间差异基质蛋白表达的火山图。(D) 弦图(左)表示细胞间粘附配体和受体之间的潜在相互作用。定量信息(右):细胞类型之间潜在相互作用蛋白质的总数。(E) α5-整合素 (ITGA5)、β1-整合素 (ITGB1) 和纤连蛋白 (FN1) 的蛋白质丰度。(F) SBT 和 LGSC-PT 中的 ITGB1 和 FN1 的免疫组织化学分析。(G) MMP2 及其调节因子TIMP3 的基质细胞蛋白丰度。(H) MMP 释放诱导因子 CD147 (BSG) 的上皮细胞蛋白丰度。(I) 参与糖异生的蛋白质向 LGSC 和相应的转移方向增加。(J) NNMT 蛋白丰度和免疫组织化学。
04
浆液性交界性肿瘤进展为侵袭性低级别浆液性癌的空间转录组学分析
他们利用 GeoMx 技术对先前通过空间蛋白质组学分析的四种组织学的连续切片进行了空间转录组学研究(图 1 A -B),该实验涉及与超过 18000 个 RNA 探针杂交,然后进行聚焦紫外线照射,以从目标细胞类型中选择性释放探针条形码进行测序分析。测序数据通常表明饱和度较高。为了将空间转录组与蛋白质组比对,他们采用免疫荧光染色,使用区室特异性抗体来匹配相应的 ROI(图 4 A)。SBT 和 LGSC-PT 之间上皮细胞中共有 1386 个转录本存在差异表达(表 S4 C)。SBT 显示调节黏蛋白的 AGR2 和形成凝胶的黏蛋白 MUC5B 上调(图 4 B)。同时,LGSC-PT 中 CA-125 结合伴侣间皮素 (MSLN) 和丝氨酸蛋白酶 KLK6(一种与卵巢肿瘤复发相关的 MAPK 调节蛋白)的水平较高。LGSC -PT 中 SPOCK2 和 γ-突触核蛋白 (SNCG) 等几种神经系统相关转录本也上调(图 4 B)。
在SBT向LGSC进展的过程中,SBT-MP表现出MAPK调控转录因子MAZ和卵母细胞发育相关DUX4 39的早期上调。其他早期变化包括JUNB、FOS和FOSL2表达增加,这些表达从SBT到SBT-MP有所上升,在侵袭性肿瘤中保持高水平,并且与HGSOC 40的化学耐药性相关(图4 C),这与它们的上游调节因子EGFR和SHC1一致。相反,与SBT相比,侵袭性癌症表现出孕激素相关子宫内膜蛋白 (PAEP) 和p53稳定转录抑制因子HIC1的下调。GSEA 通路分析显示,MUC3A、MUC5B 和 MUC16 (CA-125) 等黏蛋白发生了变化,同时组织迁移、信号蛋白信号转导和 c-MET 相关信号转导也发生了改变(图 4 D、S10 D 和 S10E;表 S4 E)。c-Met 受体酪氨酸激酶在 LGSC 和转移瘤中转录本水平显著上调,通过 IHC 证实了这一点(图 4 E-F)。与 c-MET 信号转导相关的上调转录本包括通路调节因子(HGS、ARF6 和 RAB4A)和信号元件(SHC1、PTPN11 和 PTK2)。为支持空间蛋白质组学数据,他们还发现 CDK 信号调节成分发生了变化,包括 LGSC-PT 中 G1/S 特异性细胞周期蛋白 D1 (CCND1) 的上调以及 G1/S 转换调节剂和肿瘤抑制因子 RB1 的下调。PCA 显示上皮中的 SBT 和 SBT-MP 之间存在差异,而基质基因表达将 SBT/SBT-MP 与 LGSC-PT/LGSC-Met 区分开来(图 4 G)。SBT 和 LGSC 之间显示上调的几个基质转录本,例如 S100A10、C3 和 NNMT(图 4 H),与空间蛋白质组学鉴定的转录本相匹配,提供了两种模式之间的交叉确认(图 3C)。他们还发现了仅作为转录本检测到的基因变化,例如金属蛋白酶、ADAM15 和参与氧稳态的因子(例如 VEGFA 和 HIF1α),这些变化在从 SBT 到 SBT-MP 的转变过程中有所增加(图 4 I)。有趣的是,干细胞标志物 LGR5 和 FOXL2 在 SBT 中丰度较高,但随着肿瘤的转化和转移而逐渐下降。此外,神经轴突导向因子 SLIT2 在 LGSC-Met 中高表达,而细胞粘附蛋白 CDHR1 下调。在 CAF中,仅在 RNA 水平上调的基因包括与血管生成和缺氧相关的基因(图 4J)。
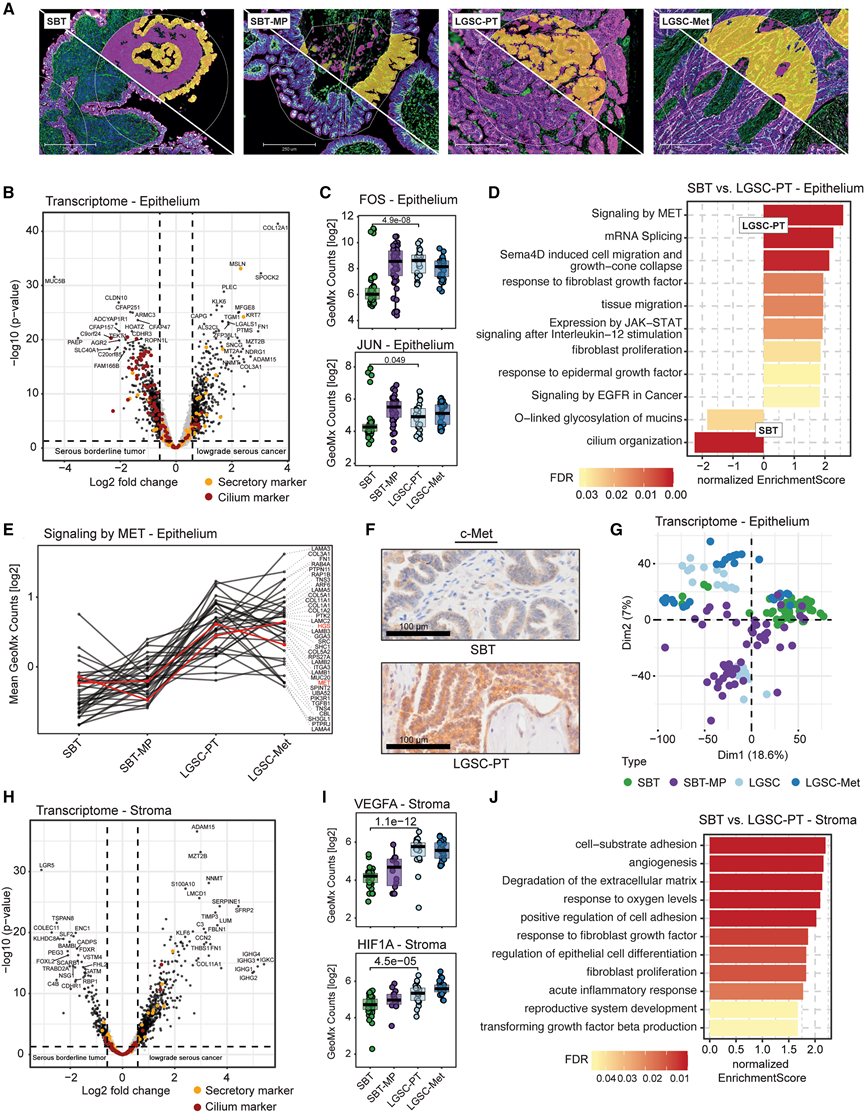
图4. SBT和LGSC的空间转录组学分析。
(A) 示例性区域的全细胞角蛋白(紫色)、核心蛋白聚糖(绿色)和细胞核(蓝色)的免疫荧光分析。(B) 交界性癌和低级别浆液性癌的上皮区段差异转录本分析(火山图)。(C) GeoMx 在整个进展系列中计算 JUN 和 FOS。(D) 基于上皮区室(Pathway REACTOME,基因本体生物过程)中 SBT 和 LGSC-PT 的空间转录本结果比较,在(B)上进行 GSEA 生物通路富集分析。(E) MET 信号通路相关蛋白的剖面图。(F) SBT和LGSC-PT中c-MET的IHC检测。(G) 使用上皮中的转录本对所示组织学进行PCA 分析。(H) SBT 与 LGSC-PT 的差异转录本丰度。(I) GeoMx 在整个进展系列中对 VEGFA 和 HIF1α 进行计数。(J) 使用基质区室中的 SBT 和 LGSC-PT 中的空间转录本结果对(H)中的 GSEA 生物通路富集分析进行比较。
05
多模态空间数据的整合揭示了复杂的分子模式
他们整合了多组学数据和 H&E 染色结果以全面分析肿瘤器官(图 5 A),发现基质中有 67.7% 的蛋白质和 32.7% 的转录本重叠,而上皮中则有 67.9% 的蛋白质和 44.5% 的转录本重叠。差异表达蛋白质和转录本的重叠率较低,基质中有 30.9% 的蛋白质和 18.9% 的转录本重叠,上皮中有 20.7% 的蛋白质和 14.2% 的转录本重叠。许多基因在转录组数据中仅作为转录本检测到,许多基因在 DVP 数据中仅作为蛋白质检测到。两种技术均显示出充分的细胞类型分层,与 GeoMx 相比,DVP 的分离效果更好,并且细胞类型特异性标记物显著富集。
对四种组织学中的蛋白质组和转录组数据集的分析表明,在从 SBT 到 LGSC-Met 的转变过程中,上皮细胞中的 4992 个基因中有 1142 个基因呈正相关(图 5B)。在基质中,3746 个基因中只有 84 个基因的转录本和蛋白质之间显著相关(图 5C)。上皮区室中只有 32 个基因在整合数据之间呈负相关,包括 ABT1、ZMIZ1 和 CIR1,以及基质中的 CHST14。叶酸受体 α (FOLR1) 在两个数据集和 IHC 中显示出一致的上皮表达水平。FOLR1 是 药物mirvetuximab soravtansine 的治疗靶点,mirvetuximab soravtansine 是 FDA 批准的用于治疗铂耐药性高级别浆液性癌的药物,但目前不用于 LGSC(图 5D)。此外,他们观察到与上皮性LGSC-PT相比,LGSC-Met中FOLR1的表达增加(图S4 E)。细胞周期蛋白依赖性激酶CDK4在两个数据集中均呈上调,而CDK抑制因子CDKN2A则持续下调(图5 E-F)。CDK6在蛋白质组学水平上调,但在转录组学水平上没有上调(图5 G)。
为了鉴定肿瘤发生的标志物,他们使用了多组学因子分析 (MOFA+)框架来整合所有数据集。MOFA+ 识别数据中的潜在因子和潜在的变异轴,总结了跨数据集的主要变异来源。整合验证了 SBT-MP 作为过渡阶段,并揭示了 LGSC-PT 的异质性基质(图 5 H-I)。基于 MOFA+ 分析分数,他们生成了与肿瘤发生相关的目标标志物面板。他们分别针对上皮细胞或基质细胞选择了十个得分最高的、具有显著上调或下调的蛋白质和转录本。这两种技术都将其中大部分鉴定为潜在的生物驱动因素(例如上皮中的 SNCG 以及基质中的 NNMT、POSTN 和 ADAM15)。
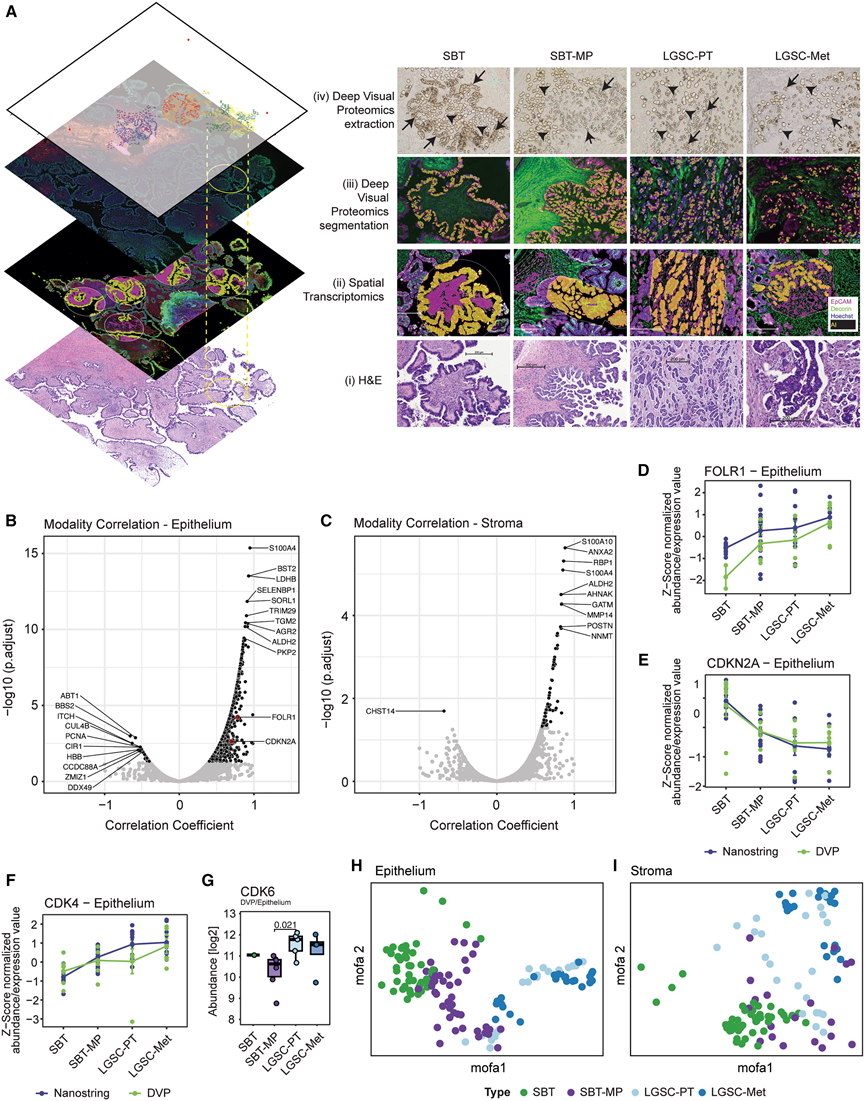
图5. 空间转录组学与蛋白质组学的整合分析。
(A) 深度可视化蛋白质组学和空间转录组学针对四种组织学亚型的多层整合。(B-C) 比较空间蛋白质组学和转录组学的蛋白质与转录本表达相关性。(D-F) Z评分标准化的 FOLR1、CDKN2A和 CDK4的蛋白质和转录本丰度。(G) CDK6 的箱线图(蛋白质丰度)。(H-I) 使用多组学因子分析 (MOFA+) 生物信息学平台整合转录组和蛋白质组数据,结果显示癌症上皮和基质队列组明显分离。
06
体外和体内筛选药物治疗靶点
在表征了进展至转移性 LGSC 的蛋白质组学和转录组学图谱后,他们研究了潜在驱动因素在 SBT 和 LGSC 之间转变中的功能意义。通过蛋白质组学分析技术对 LGSC 细胞系进行了表征,结果显示其与 SBT 和 LGSC-PT 上皮的蛋白质组学谱呈正相关。VOA6406 与 SBT 以及 VOA4627 与 LGSC-PT 之间的相关性最高(图 6 A)。蛋白质组学和转录组学数据整合有助于 siRNA 筛选的靶标选择。敲低 ADAM15、CLIC3、POSTN、SNCG 和 NOVA2 可显著抑制 VOA4627 的迁移(图 6 B)。单独敲低这些基因可抑制 VOA4627 的增殖以及 VOA4627 和 VOA6406 细胞的侵袭。 NOVA2 和 SNCG 的敲低显著抑制了 VOA6406 中的增殖,其表型比 VOA4627 更接近 SBT(图 6 C-D)。
NOVA2 在 SBT 和 SBT-MP 中缺失,但在侵袭性肿瘤中存在(图 2F-H)。敲低 NOVA2 后进行蛋白质组学分析,发现 25 种蛋白质表达降低,包括甲基转移酶 DNMT1、表观遗传调节因子 UHRF1 和细胞周期蛋白依赖性激酶 CDK1(图 6 E)。重要的是,他们发现了 c-MET 和 NOVA2 水平之间的相关性,这表明潜在的调节与 NOVA2 在侵袭性肿瘤中的独家表达有关。NNMT 是 LGSC 中上调最多的基质驱动因子之一(图 3C-J)。敲低永生化人类 CAF 中的 NNMT可抑制CAF 条件培养基驱动的 VOA4627 和 VOA6406 细胞的增殖和侵袭(图 6 F-G)
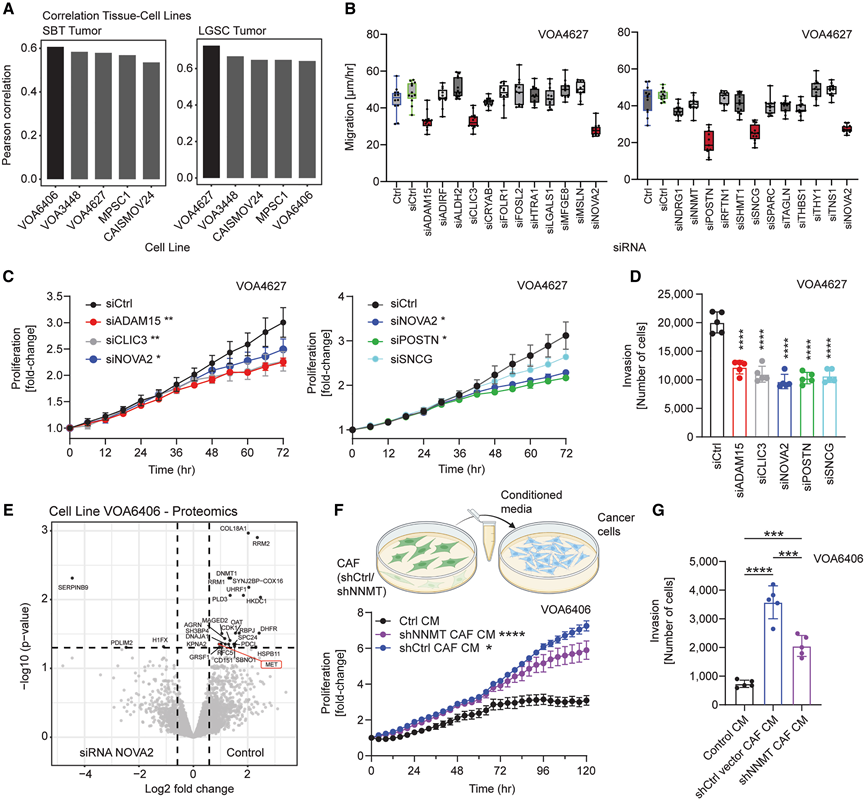
图6. SBT 向 LGSC 转变过程中“组学”衍生的潜在驱动因素的体外研究。
(A) SBT(左)和 LGSC(右)人类上皮组织与上皮性 LGSC 细胞系相比,蛋白质表达 (DVP) 相关性分析的 Pearson 系数。(B) 使用 LGSC 细胞系 VOA4627 对 23 个显著改变的基因进行 siRNA 筛选,分析细胞迁移。(C-D)增殖和侵袭分析。(E) 基于质谱的蛋白质组学分析。在 VOA6406 细胞系中,siRNA NOVA2 敲低组与对照组之间的差异表达。(F-G) 抑制癌症相关成纤维细胞 (CAF)中的 NNMT 可降低上皮细胞的增殖和侵袭。
接下来,他们研究了抑制通过分子分析和整合组学方法确定的主要通路和靶点对癌细胞增殖和侵袭的影响。几种 FDA 批准的抑制剂可有效抑制 LGSC 细胞系的增殖和侵袭,包括 c-MET 抑制剂(沃利替尼和卡博替尼)、EGFR 抑制剂(埃克替尼、拉帕替尼和厄洛替尼)、CDK 抑制剂(阿贝西利、米西利和哌柏西利)和 MEK 抑制剂曲美替尼(图7A-D)。BRAF 抑制剂达拉非尼和 FOLR1 抗体药物偶联物米维妥昔单抗索拉维坦辛选择性抑制 LGSC 细胞系增殖。mirvetuximab soravtansine 对细胞增殖而非侵袭的选择性作用与其已知的靶向微管蛋白介导的细胞增殖的作用机制一致。Jun/Fos 抑制剂 T-5224 降低了 VOA6406 的增殖,而 Jak/STAT 抑制剂芦可替尼对癌细胞的增殖或侵袭均无影响(图 7 A -C)。在成纤维细胞和癌细胞共培养实验中,MMP2/9 抑制剂 SB3CT 抑制了细胞增殖,而 TGFβR1 抑制剂 galunisertib 则同时抑制了细胞侵袭和增殖。α5β1-整合素抗体 IIA1 在共培养和单独培养癌细胞时均抑制了侵袭(图7B-D)。
他们推断,像 milciclib 这样靶向失调细胞周期进程的 CDK4/6 抑制剂,可以与针对 FOLR1 的 LGSC 疗法产生协同作用,他们发现 FOLR1 在 LGSC 及其转移灶中显著表达(图 5D)。通过在小鼠体内传代 VOA6406 细胞,他们建立了一个强大的小鼠 LGSC 模型。mirvetuximab soravtansine 和 milciclib 单药或联合用药,均显著减轻肿瘤重量、恶性腹水和转移性结节的数量(图 7E)。总之,空间蛋白质组学和空间转录组学联合鉴定的通路已证明具有治疗靶向性,展现了这种多组学方法的转化潜力。
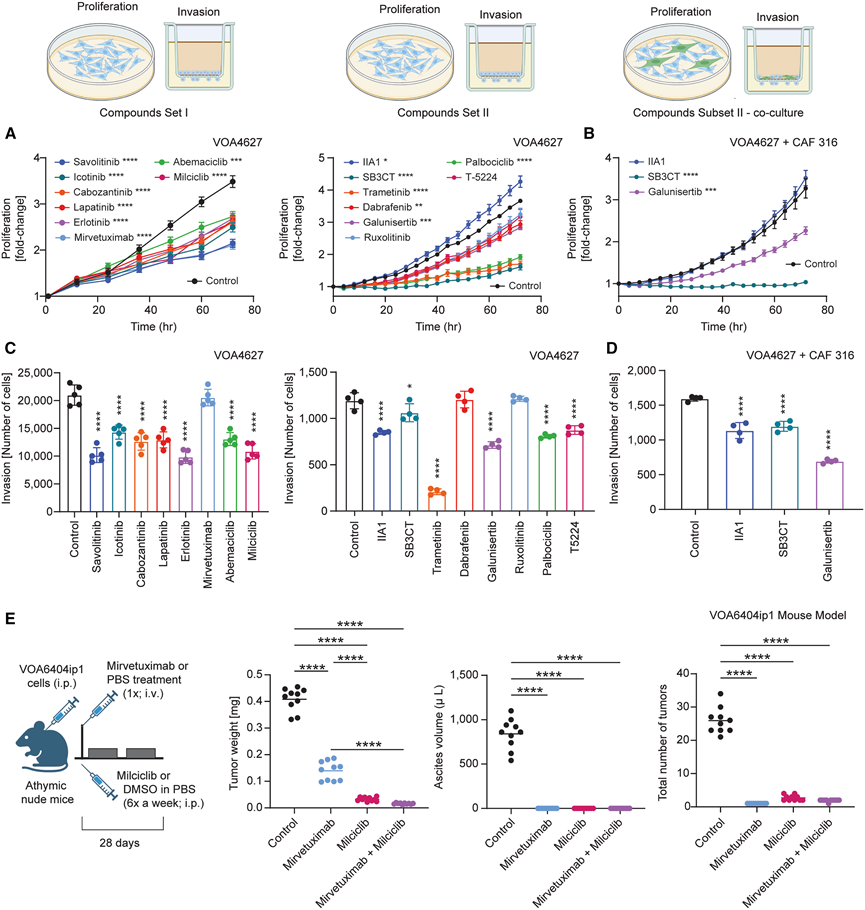
图7. 低级别浆液性卵巢癌新治疗策略的评估。
(A-D) FDA 批准或临床阶段化合物在 VOA4627 细胞中的体外评估。(E) 体内实验评估CDK抑制剂milciclib与FOLR1靶向药物mirvetuximab soravtansine单药或联合治疗的效果。
+ + + + + + + + + + +
结 论
本研究整合了细胞类型分辨的空间蛋白质组学和转录组学,以阐明从 SBT 到 LGSC 的演变及其在基质和肿瘤中的相应转移。这种转变发生在上皮细胞内,经历一个具有微乳头状特征的中间阶段,在此期间 LGSC 过表达 c-Met 和几种脑特异性蛋白。在肿瘤微环境中,癌细胞与基质细胞之间的互联互通,以及降解密集细胞外基质的酶,表明不同细胞类型之间存在功能性协作。本研究对通过整合空间转录组学和蛋白质组学确定的 16 个药物靶点进行了功能验证。针对 CDK4/6(milciclib)和 FOLR1(mirvetuximab)的联合治疗在体内实现了显著的肿瘤缩小,代表了一种有前途的 LGSC 治疗策略。
+ + + + +



 English
English


