文献解读|Cell(42.5):系统分析显示甜菜碱可作为老年保护的运动模拟物
✦ +
+
论文ID
原名:Systematic profiling reveals betaine as an exercise mimetic for geroprotection
译名:系统分析显示甜菜碱可作为老年保护的运动模拟物
期刊:Cell
影响因子:42.5
发表时间:2025.06.25
DOI号:10.1016/j.cell.2025.06.001
背 景
运动会根据持续时间和频率引起不同的生理适应。急性运动(AE)会触发对生理挑战的即时代谢和免疫反应,而定期的体育活动则会在多个生理系统上带来广泛的健康益处。长期运动(LE)会显著调节免疫功能,增强干细胞活力和组织再生能力,并通过提高认知能力来促进神经可塑性。此外,习惯性锻炼可以优化骨骼肌代谢,增强胰岛素敏感性,减轻慢性炎症,从而降低心血管和代谢疾病的风险。来自啮齿动物研究的新证据表明,LE 通过延缓系统性衰老和增强对感染的抵抗力来延长健康寿命。虽然运动的健康益处在模型生物中已得到充分证实,仍需要大量研究来阐明这些效应在人体生理学中的作用并探索其转化潜力。具体而言,缺乏对不同运动方案如何影响人类生物表型的系统描述。例如,对 AE 的瞬时反应与重复运动的累积适应效应之间的异同、它们之间的潜在相互关系以及潜在的分子机制仍不清楚。
实验设计
结 果
01
单次和连续锻炼后的生理适应
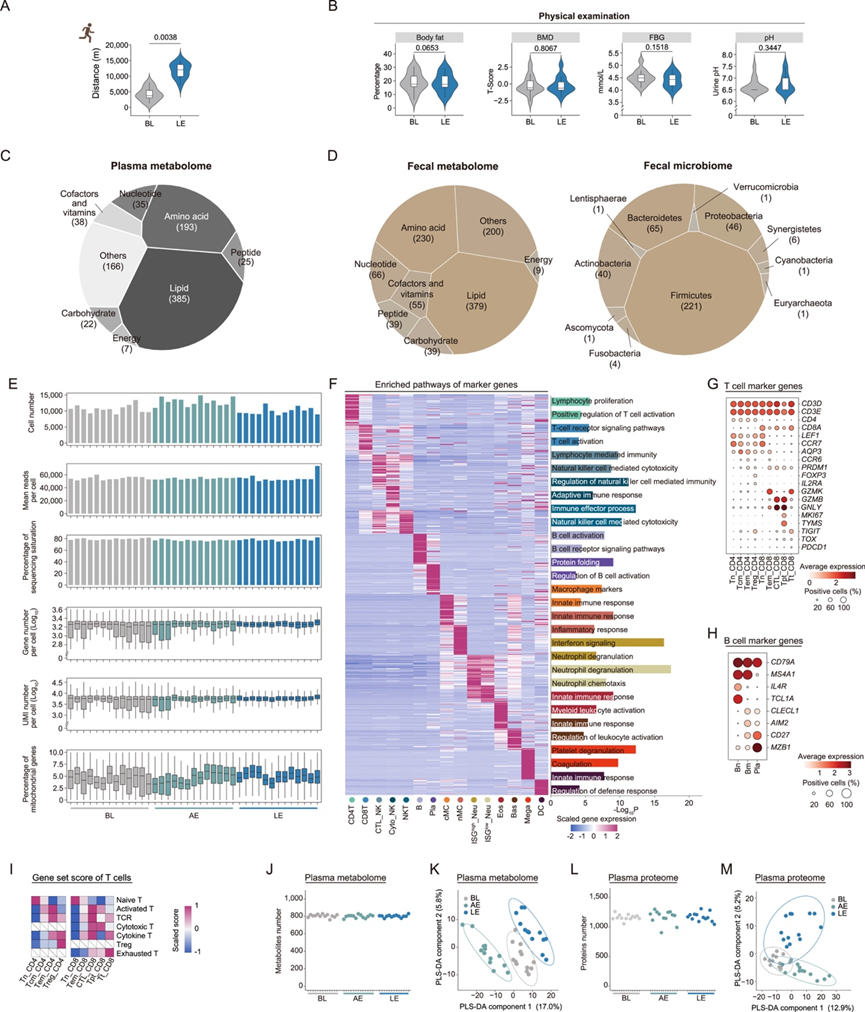
研究团队招募了 13 名健康男性参与一项三阶段运动研究:基线 (BL)、AE 和 LE(图 1 A)。参与者自始至终保持标准化饮食和睡眠方案。45 天的 BL 阶段建立了一致的初始条件,但走动活动受限(图 1 B)。AE 阶段包括以 8 公里/小时的速度跑一次 5 公里,而 LE 阶段包括 25 天的间歇性和连续性每日 5 公里跑。跑步课程的时间和地点一致。在 AE 前和 LE 后进行体格检查和粪便取样,在 AE 前、AE 后立即和 LE 后采集血样。LE 评估在 24 小时恢复期后进行,以区分慢性适应和急性反应。健身追踪器监测步行距离以确保遵守研究要求(图 1B,图S1A)。
为了评估运动的效果,他们进行了血液生化分析和 Olink 炎症因子测试,涵盖组织损伤和重塑指标、脂质代谢标志物、急性期反应和炎症指标(图 1C-D)。AE 改变了 24个生化参数,其中 87.5% 显示升高。非酯化脂肪酸 (NEFA) 增加了 2.84 倍,而总胆汁酸 (TBA) 下降至 BL 的 53%(图 1C-F)。在使用 Olink 分析的 92 个炎症因子中,33 个显示表达增加,其中细胞外新发现的 RAGE 结合蛋白 (ENRAGE) 和白细胞介素 6 (IL-6) 表现出显著的升高(图 1C)。在 LE 中,31 个血液生化参数中有 11 个显示持续性改变(图1D)。间接胆红素 (IBIL) 降低最为显著,IBIL 与直接胆红素 (DBIL) 比率降低表明 LE 后肝脏胆红素处理效率增强(图 1 F)。结合降低的γ-谷氨酰转移酶 (GGT) 和甘油三酯 (TG),这些观察结果表明代谢功能得到改善(图 1 E-G)。与 AE 期间炎症因子的显著升高不同,LE 降低了 CC 基序趋化因子配体 25 (CCL25)、高敏 C 反应蛋白 (hsCRP) 和肿瘤坏死因子-α (TNF-α) 水平(图1D-G),证明了慢性运动的抗炎潜力。同期体检显示,LE训练后生理状况有改善趋势,包括体重指数 (BMI) 降低和静息心率降低(图 1B-H,图S1B)。此外,白细胞谱的改变,以中性粒细胞减少和淋巴细胞增加为标志,提示运动诱发了外周免疫细胞重塑(图 1I)。
为了研究运动带来益处的分子机制,他们对血液成分进行了多组学分析,包括外周血细胞 (PBC) 的单细胞转录组学分析(scRNA-seq)、血浆蛋白质组学分析和代谢组学分析以及粪便微生物组/代谢组分析。整合数据集产生了 16652 种不同的分析物(图1J,图S1C-M)。scRNA-seq产生了 23 种细胞类型的 349213 个高质量单细胞(图1K,图S1E-I)。LE 在 PBC 中产生的转录组改变比 AE 更显著,中性粒细胞的反应尤为明显(图 1 L-M)。同时,LE 减少了个体间转录谱变异(图1L)。相比之下,AE对差异表达蛋白(DEP)和差异代谢产物(DPMP)的影响更为显著(图1N)。这些结果表明,AE和LE在人类外周血中诱导了不同的分子反应模式。

图1. 急性运动和长期运动效应的系统分析。
(A) 研究设计概述示意图。(B) 参与者在整个休息和锻炼期间的每日步行距离和静息心率。(C-D) 左图:饼图显示血液生化指标和 Olink 炎症因子数量的变化或不变。右图:点图显示与 BL 相比,AE或 LE后血液生化指标和 Olink 炎症因子的变化。(E-G) BL、AE 和 LE 后组织中的 NEFA、TG、TBA、GGT、hsCRP 和 TNF-α血浆浓度以及 IBIL 与 DBIL 的比率。(H-I) LE和BL的体格检查指标为BMI、体重、静息心率,血常规分析。(J) 人类外周血单细胞(sc)转录组、血浆蛋白质组和代谢组的示意图和数据集。(K) 显示人类外周血细胞(PBC)中细胞组成的示意图和UMAP图。(L) 上图:基于单链转录组数据主成分 (PC) 分析,密度图和点图显示不同组间方差分布。下图:PC1 相关基因的富集通路。(M) 基于 scRNA-seq数据,与 BL 相比,AE 和 LE 中不同细胞类型的差异表达基因 (DEG) 的数量。(N) 根据蛋白质组和代谢组数据,与 BL 相比,AE 和 LE 血浆中差异表达蛋白质(DEP)和差异代谢产物(DPMP)的数量。
图S1. 生理参数监测和体格检查。
(A) 小提琴图显示了参与者在 BL 和 LE 期间的平均每日步行距离。(B) 小提琴图显示BL和LE中不同的体检指标。(C) 树状图显示了从血浆代谢组数据中识别出的每个通路内的代谢物的数量。(D) 左图:树状图显示粪便代谢组中各超级通路中已鉴定代谢物的数量。右图:树状图显示粪便微生物组中已鉴定微生物的数量。(E) 条形图和箱线图显示 PBC的scRNA-seq数据的质量控制结果。(F) 热图显示了PBC中每种细胞类型对应的前 50 个标记基因的表达特征。(G-H) 点图显示 T 细胞和 B 细胞中不同细胞类型对应的标记基因。(I) 热图显示不同T细胞亚型中CD4 +(左)和CD8+(右)T细胞状态基因集的特征得分。(J) 点图显示血浆代谢组中检测到的代谢物的数量。(K) 血浆代谢组的偏最小二乘判别分析(PLS-DA)。(L) 点图显示血浆蛋白质组中检测到的蛋白质的数量。(M) 血浆蛋白质组的 PLS-DA。
02
AE 引起的细胞和分子层次变化
AE 后,大约一半的 PBC 细胞类型表现出细胞比例的改变(图 2A),这与运动作为免疫佐剂的作用一致。最显著的细胞动员发生在自然杀伤 (NK) 和特异性 CD8+ T 淋巴细胞中(图 2A)。这些细胞的增加可能会增强循环组织的免疫运输和监视。他们持续检测到趋化因子受体CXCR4 (一种运动反应基因)在 AE后的PBC 中的上调,在 NK 和 CD8+ T 细胞中明显表达(图 2B)。相反,幼稚 CD4+ T 细胞(Tn_CD4)和经典单核细胞(cMC)(两者均为谱系前体)的比例下降(图 2A)。AE刺激了促分化细胞因子的表达,AE相关差异表达基因 (DEG) 的分析证实了这一点。功能富集分析显示,AE后的DEG 也富集于未折叠蛋白反应和糖皮质激素受体 (GR) 通路(图2C)。RT-qPCR 证实了 GR 相关转录因子TSC22D3的上调(图2D)。
代谢组学分析进一步表征了 AE 后的代谢变化(图 2 E-J)。靶向液相色谱-串联质谱 (LC-MS/MS) 证实,皮质酮水平大幅升高,与 GR 信号的激活一致(图 2 C-G)。腺苷相关代谢物(如黄苷和肌苷)是继皮质酮之后上调最多的化合物(图 2 F),表明 AE 期间ATP周转率升高和能量需求增加,这通常与活性氧 (ROS) 生成增强有关。氧化应激反应通路在 AE 后 PBC 上调的 DEG 和上调的血浆蛋白中均一致富集(图 2 C-K)。
与皮质酮的促分解代谢作用一致,他们观察到 AE 血浆代谢物发生显著改变,并且 AE 血浆蛋白质组中代谢酶增加。与葡萄糖代谢相关的关键蛋白质,例如己糖激酶 1 (HK1) 和转酮醇酶 (TKT),得到了富集(图 2K)。丙酮酸、乳酸和 N-乳酰苯丙氨酸 (Lac-Phe) 水平升高证明了无氧糖酵解的激活(图 2H)。脂肪分解也发生激活,二酰甘油和单酰甘油减少,甘油增加(图 2E)。脂肪酸氧化 (FAO) 活化表现为短链和中链肉碱结合脂肪酸的升高,这通过 LC-MS/MS 对 3-羟基己酰肉碱和 3-羟基丁酰肉碱进行了验证(图 2 I)。长链脂肪酸积累,表明在 AE 期间优先使用短链脂肪酸。3-羟基丁酸升高表明 FAO 产物无法进入三羧酸 (TCA) 循环,而苹果酸等 TCA 循环中间体增多则证实了这一点(图 2 H-I)。此外,AE 消耗了血浆氨基酸,20 种游离氨基酸中有 18 种及其衍生物的含量减少(图 2 J)。这种运动引起的氨基酸消耗可能反映了器官消耗的增加。此外,他们检测到补体和纤维蛋白原蛋白的循环水平下降(图 2 L),反映了它们在运动引起的轻度组织损伤引发的修复过程中可能消耗。
结合多组学数据的整合通路分析 (IPA) 揭示了运动反应代谢物/蛋白质与预测的 PBC 转录变化上游调节因子之间的相关性(图 2 M)。关键调节因子包括皮质酮、嘌呤代谢物和细胞因子(IL-6 和表皮生长因子 [EGF]),它们在 AE 后血浆水平升高(图 2 M)。IL-6 参与跨免疫细胞的转录调控,靶基因在抑癌素 M (OSM) 和 IL-10 通路中富集,这与 AE 诱导的两种因子的血浆上调一致(图 1 C)。此外,血液生物化学与蛋白质组学和代谢数据集的整合揭示了强烈的类别内相关性,同时显示蛋白质组学和代谢数据之间的类别间关联相对有限(图2N-P)。一个显著的例外是羟酰基谷胱甘肽水解酶 (HAGH),这是一种将 S-乳酰谷胱甘肽转化为还原谷胱甘肽和 D-乳酸的硫酯酶,其在 AE 血浆中的上调与复合脂质呈负相关,特别是1-棕榈酰-GPE (16:0) 和胆固醇。在血液生化指标中,NEFA 主要与脂质代谢物相关,而天冬氨酸氨基转移酶 (AST)、肌酸激酶同工酶 (CK-MB)、腺苷脱氨酶 (ADA) 和 hsCRP 与补体因子呈负相关(图 2 P)。总之,这些结果揭示了全身性变化,包括 AE 后的免疫细胞活化和动员能量代谢。
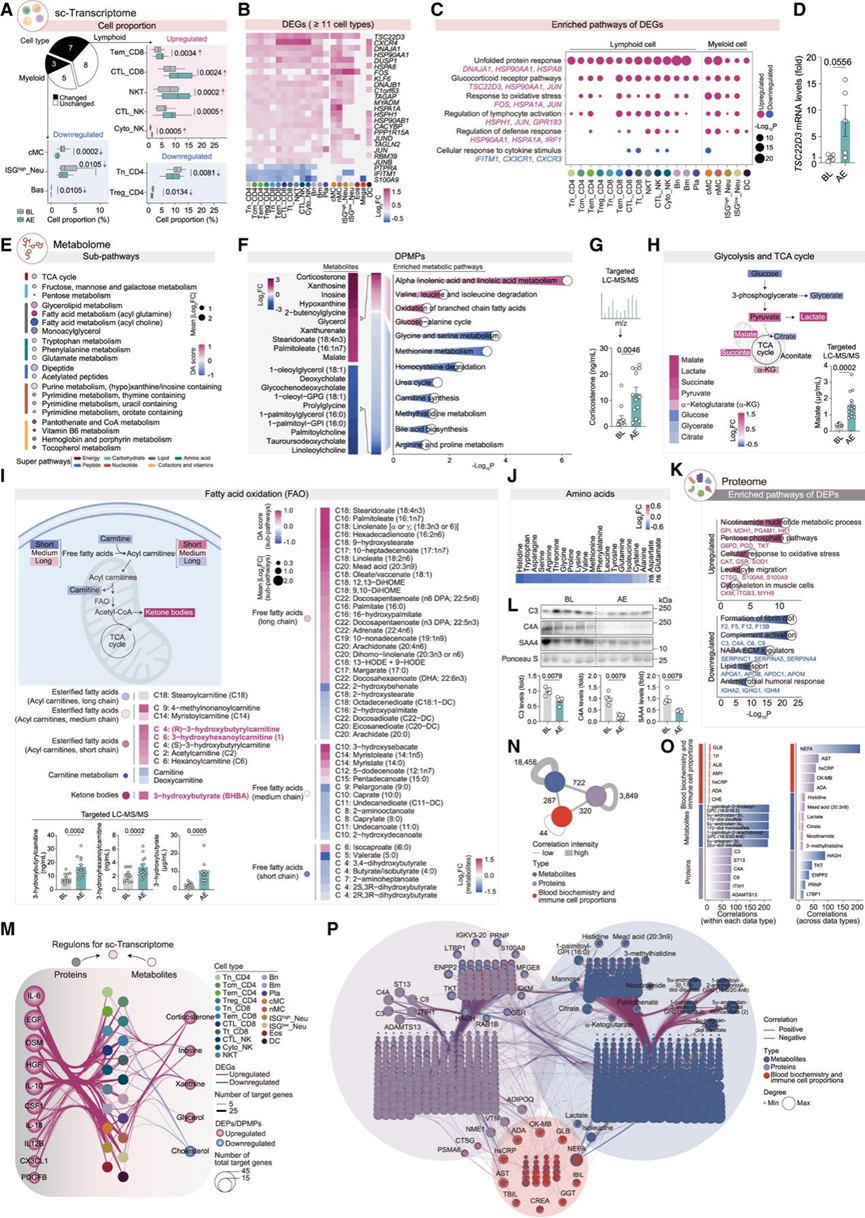
图2. AE引发的多层次细胞和分子改变。
(A) 饼图显示比例变化或不变的PBC细胞类型数量。箱线图显示不同细胞类型的比例。(B) 不同 PBC 细胞类型(显示 ≥11 种细胞类型)的 DEG。(C) 不同 PBC 细胞类型中 DEG 的富集通路。(D) BL 和 AE后PBC 中TSC22D3 mRNA 水平的 RT-qPCR 分析。(E) 血浆代谢物的差异丰度 (DA) 和平均变化(AE与 BL)。(F) 左图:前10个改变的DPMP(AE vs. BL)。右图:基于小分子通路数据库 (SMPDB) 富集的DPMP代谢通路。(G) 靶向液相色谱-串联质谱 (LC-MS/MS) 分析指定组血浆中的皮质酮。(H) 糖酵解和三羧酸 (TCA) 循环中 DPMP 的示意图(上)和差异倍数(左下)。右下:各组血浆中苹果酸的靶向 LC-MS/MS 分析。(I) 左上:脂肪酸氧化(FAO)过程示意图。中左和中右:各通路的DA和平均变化量,以及FAO中DPMP的差异倍数。左下:各组血浆中不同代谢物的靶向LC-MS/MS分析。(J) 血浆中氨基酸的差异倍数。(K) 血浆中 DEP 的富集通路。(L) 各组血浆中 C3、C4A 和 SAA4 的免疫印迹分析。(M) 基于 AE 相关 scRNA-seq 数据,对 AE 相关血浆 DEP/改变的炎症因子、AE 相关血浆 DPMP 以及综合通路分析 (IPA) 预测的上游调节剂之间的重叠进行网络可视化。(N) 网络图显示了改变的血浆蛋白、代谢物以及血液生物化学和免疫细胞比例 (AE 与 BL) 之间的相关性。(O) AE 后的血浆代谢物、蛋白质、血液生物化学和免疫细胞比例在同一数据类型(左)和不同数据类型(右)中的相关性数量。(P) 网络图显示了与 BL 相比 AE 数据在不同维度上的相关性。
03
LE重塑外周免疫细胞
LE后的 scRNA-seq数据显示,超过 60% 的免疫细胞类型比例发生改变,其特征是淋巴细胞增多,尤其是所有幼稚淋巴细胞群,而髓系细胞减少,尤其是中性粒细胞减少,这与血常规结果一致(图1I,图3 A-B)。幼稚淋巴细胞与其子代细胞的比较揭示了不同的分化潜能,CD4+ T 细胞的分化较高,而 CD8+ T细胞的分化较低。同时,中枢记忆 CD4+ T 细胞 (Tcm_CD4) 显示幼稚状态相关基因表达升高(图3B),表明与干细胞相关的状态。与AE 诱导的趋化因子受体上调不同,LE 提高了 CORO1A 和 CD74的表达,表明主动免疫细胞迁移和动员能力增强(图3C-D)。
LE后PBC 中上调的 DEG 与细胞衰老减轻相关,这由基因组稳定性相关基因(XRCC6、DDX5、BRD4和TAF10)表达升高所证明。免疫荧光显示磷酸化 H2AX (γ-H2A.X) 水平降低,证实了这些变化(图 3 E-G)。LE后的PBC 持续表现出增强的异染色质标记 H3K9me3(图 3H)。这些细胞还显示磷酸化的 NRF2 增加和 NRF2 反应基因(TXN、GPX1、SOD1和GSTP1)表达上调,表明细胞抗氧化能力增强(图3F-I)。这些研究结果表明,定期运动可以减轻淋巴细胞衰老并增强其活性。
LE后PBC 表现出核糖体组装基因的广泛下调(图 3 E)。IPA 鉴定出 ETS1(核糖体生物合成的核心转录因子)是 LE 下调 DEG 的主要上游调节因子,其在多种淋巴细胞亚型中的表达均降低(图 3 J -K)。在人类幼稚 CD4+ T 细胞中, CRISPR-Cas9 介导的ETS1基因敲除(图3L-M)与 LE 效应大致相等,扩增 Tcm_CD4 并上调 CD28 表达(一种与 T 细胞存活相关的蛋白质) (图 3N-O)。ETS1 缺失的 T 细胞表现出更年轻的状态,包括 H3K9me3 升高和衰老或衰竭标志物(γ-H2A.X 和 PD-1)降低(图 3 P-Q)。ETS1敲低后,表达TNF- α的 T细胞减少(图3R )。转录组分析进一步证实了 ETS1 敲低后的这些表型,显示 T 细胞活化和存活基因上调,同时 I 型干扰素信号传导基因下调,包括IFITM1,该基因在 LE后PBC 的 16 种细胞类型中下调(图 3C-S)。这些结果表明 ETS1 是 LE 诱导的 T 细胞活化、调节衰老和分化的关键分子开关。
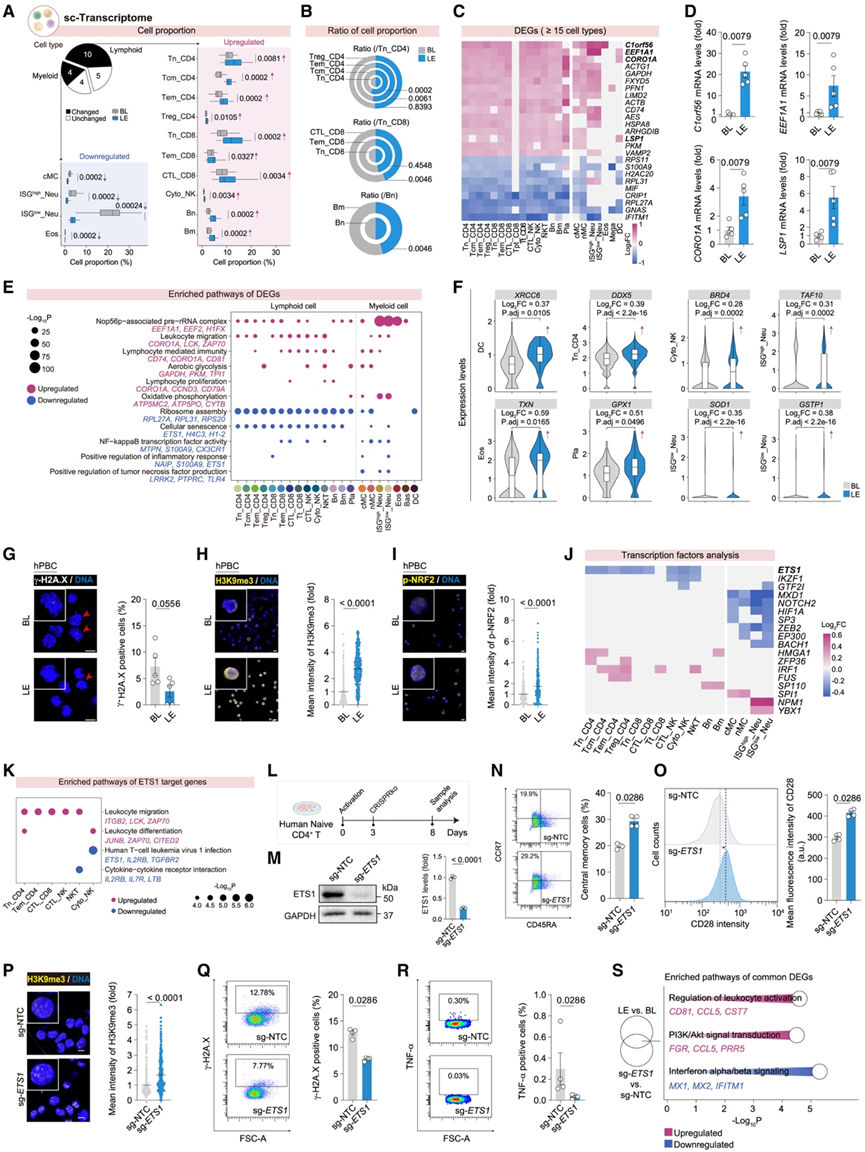
图3. 响应 LE 的外周血免疫适应。
(A) 饼图显示PBC细胞类型数量(LE vs. BL),其比例发生变化或保持不变。箱线图显示不同细胞类型的比例。(B) LE 和 BL 中不同 CD4 + T、CD8 + T 和 B 细胞亚型与其幼稚细胞类型的相对比例。(C) 不同 PBC 细胞类型(显示 ≥15 种细胞类型)的 DEG(LE 与 BL)。(D) PBC 中指示基因的 mRNA 水平的 RT-qPCR 分析。(E) 不同 PBC 细胞类型中 DEG (LE 与 BL) 的富集通路。(F) LE 和 BL 不同细胞类型中指示基因的表达水平。(G-I)免疫染色分析。(J) 不同 PBC 细胞类型 (LE 与 BL) 的转录因子 (TF) 分析。(K) 不同 PBC 细胞类型(LE 与 BL)中 ETS1靶基因的富集通路。(L) ETS1 敲除的实验流程以及人类幼稚 CD4+ T 细胞的分析。(M)免疫印迹分析。(N-O)流式细胞分析。(P) 人类 CD4 + T 细胞中 H3K9me3 的免疫染色分析。(Q-R)流式细胞分析。(S)功能富集分析。
04
LE诱导的分子适应变化
与 AE 相比,LE 血浆代谢物变化不太明显且类型不同(图 1 N、4 A、4B 和S3 F–S3K)。LE 维持相对稳定的皮质酮水平,同时伴有手性肌醇升高,手性肌醇是激素和糖脂代谢的调节剂(图 4 B)。LE 血浆还显示氧化糖酵解和 TCA 循环代谢物增加,而没有无氧糖酵解标志物,表明有效的糖酵解-TCA 偶联(图 4 A-C)。这与 scRNA-seq数据显示各种 PBC 中有氧糖酵解和氧化磷酸化基因上调相一致(图 3 E)。
与急性肾损伤组(AE)相比,LE 组的脂肪酸利用率有所提高,表现为长链脂肪酸-肉碱结合物增加,循环长链脂肪酸减少(图 2 I,图4 D)。与急性肾损伤组的氨基酸消耗不同,LE 组血浆中氨基酸波动较小,蛋氨酸代谢活跃(图 4 A-E),这可能是由于 LE 组中甲基供体代谢物(如 S-甲基蛋氨酸和甜菜碱,也称为三甲基甘氨酸)增加所致(图 4 E)。
此外,偏最小二乘判别分析 (PLS-DA) 表明,LE 诱导的血浆蛋白变化与 AE 中的不同。LE 上调的蛋白质主要与老年保护有关,例如抗氧化防御和长寿相关蛋白质,包括超氧化物歧化酶 1 (SOD1)、谷胱甘肽过氧化物酶 1 (GPX1)、过氧化物酶 1 (PRDX1) 和过氧化氢酶 (CAT)(图 4 F),这与之前的观察结果一致(图 3 F-I)。他们进一步确定,LE 后血浆中 SOD1 的蛋白质水平和 SOD 活性升高(图 4 G)。值得注意的是,血红蛋白亚基 β (HBB) 是 LE 上调的蛋白质之一(图 4 F)。这与低脂血红素(一种低脂诱导的血浆代谢物)的含量一致,支持了持续运动能够促进功能性血红蛋白生成和携氧能力的观点(图 4B)。低脂血红素下调的蛋白质包括补体和纤维蛋白原因子的成分、胆固醇清除蛋白的负调节因子以及促炎蛋白,例如 SAA4(图 4F-H)。这与循环胆汁酸代谢物和甘油三酸酯(TG)的减少相一致,表明代谢和免疫功能得到改善(图1D-F)。
通过 IPA 整合多组学数据,他们鉴定出与 LE后PBC 转录调控有关的关键分子,包括甜菜碱和谷氨酰胺等代谢物以及 CXCL10 等细胞因子(图 4 I)。进一步将这些变化与血液生化和免疫细胞比例关联起来,与 AE 相关模式不同,更多比例的代谢物和血浆蛋白充当了连接 LE 多维变化的关键因子(图4J-L),主要由与胆固醇代谢相关的蛋白质组成,例如胆固醇酯化蛋白 ACAT2 和胆固醇清除抑制蛋白 PCSK9(图 4 L)。
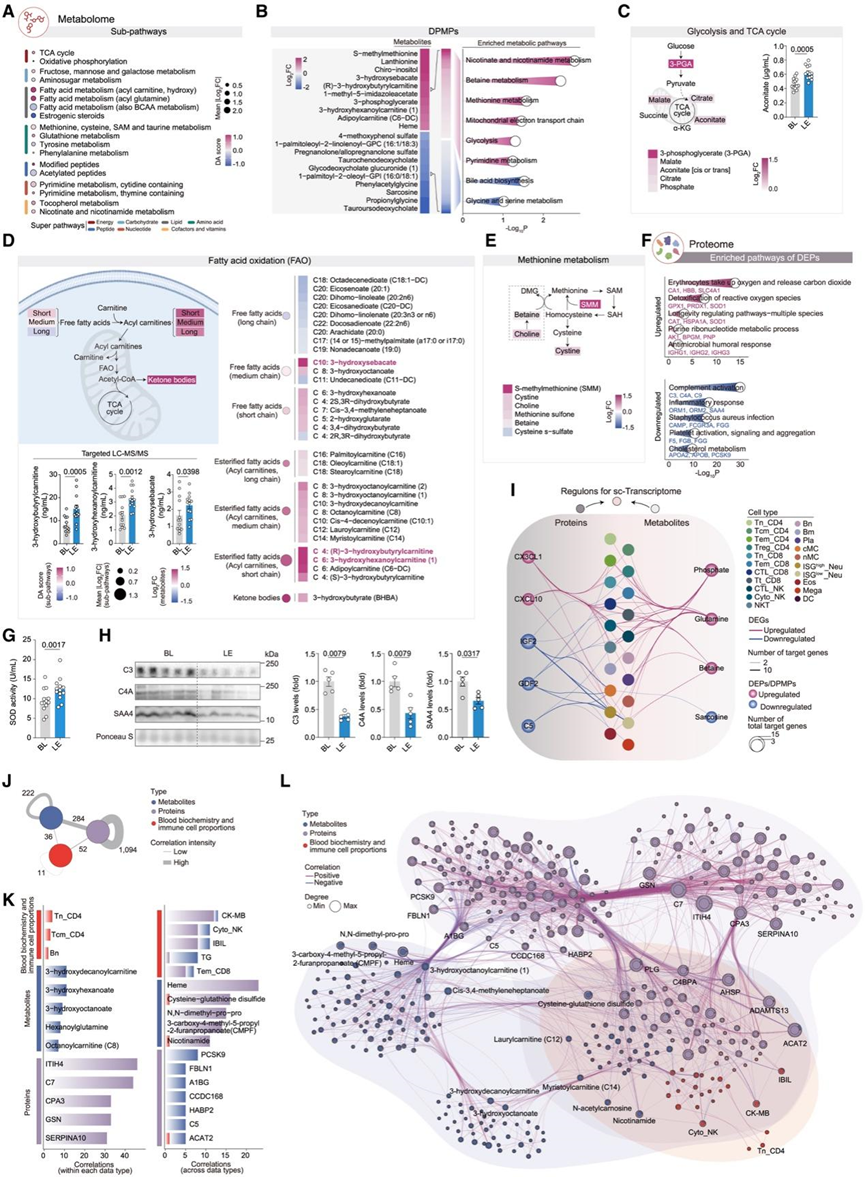
图4. LE相关的分子网络变化。
(A) DA 和血浆代谢物各通路的平均变化。(B) 左图:前10个改变的DPMP(LE vs. BL)的差异倍数 。右图:基于SMPDB富集的DPMP(LE vs. BL)代谢通路。(C) 左上:糖酵解和三羧酸循环示意图。右上:各组血浆中乌头酸的靶向LC-MS/MS分析。下图:DPMP(低剂量组 vs. 低剂量组)的差异倍数与糖酵解和三羧酸循环的关。(D) 左上:FAO 过程示意图。右图:各通路的 DA 和平均变化,以及与 FAO 相关的 DPMP(LE vs. BL)的差异倍数。左下:各组血浆中指示代谢物的靶向 LC-MS/MS 分析。(E) 上图:蛋氨酸代谢示意图。下图:DPMP(LE vs. BL)的差异倍数与蛋氨酸代谢的关系。(F) 血浆中 DEP(LE 与 BL)的富集通路。(G) LE 和 BL 血浆中的超氧化物歧化酶 (SOD) 活性测定。(H) LE 和 BL 血浆中 C3、C4A 和 SAA4 的免疫印迹分析。(I) 基于 LE 相关 scRNA-seq 数据,对 LE 相关血浆 DEP/改变的 Olink 炎症因子、LE 相关血浆 DPMP 和 IPA 预测的上游调节剂之间的重叠进行网络可视化。(J) 网络图显示了改变的血浆蛋白、代谢物、血液生物化学和免疫细胞比例之间的相关性。(K) 与 BL 相比,LE 数据的血浆代谢物、蛋白质、血液生物化学和免疫细胞比例在同一数据类型(左)或不同数据类型(右)之间的相关性。(L) 网络图显示了 LE 数据与 BL 在不同维度上的相关性。
05
LE重塑粪便微生物群稳态
与血浆代谢物的显著变化相比,粪便代谢物在 LE 后表现出有限的变化(图 5 A-B)。联合分析显示,嘧啶和脂肪酸代谢中粪便和血浆代谢物之间存在相关性(图 5C)。例如,LE 粪便中的复合脂质和长链游离脂肪酸减少,类似于 LE 血浆中的模式(图5A)。值得注意的是,二氢乳清酸等嘧啶代谢物在 LE 粪便中富集,而乳清酸苷、3-氨基异丁酸和 3-脲基丙酸等衍生物在 LE 血浆中富集(图 5 C)。
宏基因组分析表明,LE 选择性地减少了微生物种群,包括机会性病原体,同时保留了整体微生物多样性(图 5 D)。与炎症性肠病和自身免疫性疾病相关的Ruminococcus torques在 LE 中显著降低(图 5 D)。功能性微生物组分析一致表明细菌脂多糖 (LPS) 和常见抗原的生物合成能力下降(图5 E)。值得注意的是,粪便分析和血浆变化之间的联系表明粪便微生物群与血浆蛋白质/代谢物之间的关联比与粪便代谢物的关联更强。例如,LE 降低的Ruminococcus torques与宿主血浆中补体蛋白的减少相关,而另一种 LE 降低的微生物 与血浆脂质表现出更强的关联。这些发现表明,LE 重塑了粪便微生物群,有助于限制病原体的产生并减少全身脂肪酸的消耗。
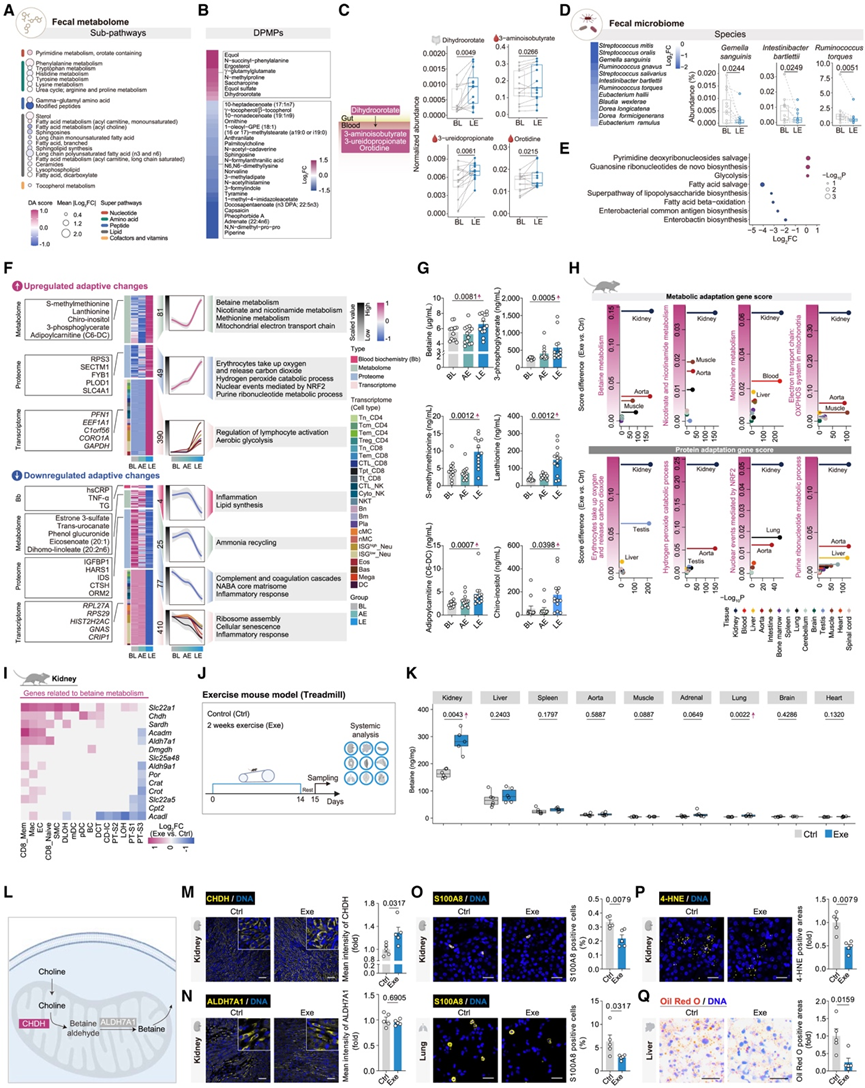
图5. 患有 LE 的人和运动小鼠的甜菜碱相关代谢通路。
(A) 粪便代谢组每个子途径的 DA 和平均变化。(B) 热图显示粪便 DPMP 的差异倍数。(C) 箱线图显示指示代谢物的相对丰度变化。(D) 粪便微生物组的差异倍数和相对丰度变化。(E) 粪便微生物通路丰度的差异。(F) 热图和折线图显示了各组间具有自适应变化的特征的缩放值,包括LE特有的变化以及与AE变化相反的变化。(G) 对 LE、AE 和 BL 血浆中指示代谢物进行靶向 LC-MS/MS 分析。(H) 基于小鼠多器官转录组学数据,适应基因评分。(I)小鼠肾脏不同细胞类型中甜菜碱代谢相关基因的差异倍数。(J) 16个月大雄性小鼠两周跑步机锻炼方案示意图。(K) Exe 和 Ctrl 小鼠组织中甜菜碱的靶向 LC-MS/MS 分析。(L) 内源性甜菜碱代谢通路示意图。(M-P)免疫染色分析。(Q) Ctrl 和 Exe 小鼠肝脏中的油红 O 染色,并对阳性区域进行定量。
06
甜菜碱作为 TBK1 抑制剂发挥抗炎作用
为了测试甜菜碱是否有助于 LE 的健康益处,尤其是其抗炎作用,他们使用 LE 血浆中的甜菜碱浓度进行了细胞测定。实验在人肾皮质上皮细胞 (hRCEC)、人巨噬细胞 (hMAC)、人间充质祖细胞 (hMPC) 和人主动脉内皮细胞 (hAEC) 中进行,这些细胞均与血管或高度血管化的器官密切相关(图 6 A)。在 LPS 刺激下,模拟微生物感染情景,甜菜碱预处理降低了 TNF-α、IL-6 和 IL-8 的表达和分泌,并降低了 hMAC 中的 ROS 水平(图6 B)。转录组分析证实甜菜碱抑制了 hMAC 中炎症相关基因的表达(图 6 C)。在其他细胞类型(包括hRCEC、hMPC和hAEC)中也观察到了类似的抗炎作用,这些细胞中甜菜碱可抵消LPS诱导的细胞因子表达(图6D-F)。此外,甜菜碱还能阻止LPS诱导的单核细胞粘附于hAEC(图6G)。这些发现共同支持了甜菜碱的抗炎作用,尤其是在感染相关情况下。
为了确定甜菜碱的分子机制,他们使用生物素化的甜菜碱通过 LC-MS/MS 鉴定了 hMPC 中的结合伙伴。这些分析确定了 TANK 结合激酶 1 (TBK1),一种关键的先天免疫激酶,是甜菜碱的主要结合靶点(图 6 H)。体外结合试验证实了甜菜碱和重组 TBK1 之间的直接相互作用(图6I)。为了评估甜菜碱对 TBK1 活性的影响,他们用甜菜碱处理 TBK1 过表达的 hMPC,观察到 TBK1 自身磷酸化和干扰素调节因子 3 (IRF3) 磷酸化均显著降低(图6J-K)。通过使用 IRF3 作为底物的体外激酶测定进一步证实了甜菜碱对 TBK1 的直接抑制作用。此外,甜菜碱抑制了LPS诱导的TBK1活化以及随后IRF3和核因子κB (NF-κB)亚基p65的磷酸化以及hMPC中的促炎因子表达(图6E-N)。这些结果证实甜菜碱是一种内源性TBK1抑制剂,而LPS诱导的甜菜碱升高可能抵消TBK1介导的炎症级联反应。
为了验证体外研究结果,他们建立了LPS诱导的小鼠模型(图6 O)。甜菜碱预处理可降低LPS诱导的肾脏组织中TBK1磷酸化(图6 P)。此外,甜菜碱预处理持续减弱了LPS诱导的各种免疫细胞的浸润,包括CD45+泛免疫细胞、CD79B+B细胞和S100A8+中性粒细胞(图6 Q)。此外,甜菜碱下调了肾脏、脾脏和小肠中的关键炎症细胞因子(TNF-α和IL-1β)(图6 R),并降低了循环血浆IL-6水平(图6 S)。转录组分析进一步表明,甜菜碱治疗可抑制LPS刺激小鼠肾脏组织中促炎基因的表达,尤其是参与NF-κB和TNF信号通路的基因表达(图6T)。这些发现支持甜菜碱在体内具有对抗感染相关炎症的保护作用,这种作用至少部分是通过TBK1拮抗作用介导的。
据报道,TBK1除了调节先天免疫外,还能驱动细胞和器官衰老。接下来,他们检测了甜菜碱是否可以作为TBK1抑制剂来缓解细胞衰老。在各种细胞衰老模型中,包括复制性衰老和由不同应激源(例如过氧化氢、IgG和依托泊苷)诱导的衰老,甜菜碱有效缓解了衰老表型(图6 U-W)。这表现为衰老相关β-半乳糖苷酶 (SA-β-Gal)阳性细胞减少、p21 表达降低、DNA 损伤指标 γ-H2A.X 降低以及异染色质标记 H3K9me3 升高(图 6 V-W)。甜菜碱处理还增强了细胞的抗氧化能力,表现为NRF2 磷酸化增加和ROS积累减少。此外,甜菜碱处理后 SASP 因子的表达和分泌减少。甜菜碱的这些抗衰老特性在多种细胞类型中得到了一致的证实,包括 hMAC、hMPC、hAEC、hRCEC 和小鼠肾皮质上皮细胞 (mRCEC)(图 6 V-W),表明其具有可普遍化的作用机制。正如预期的那样,甜菜碱的抗衰老作用与其对 TBK1 活性的抑制有关(图 6 X),支持了甜菜碱对 TBK1 活性的调节有助于其抗衰老作用。
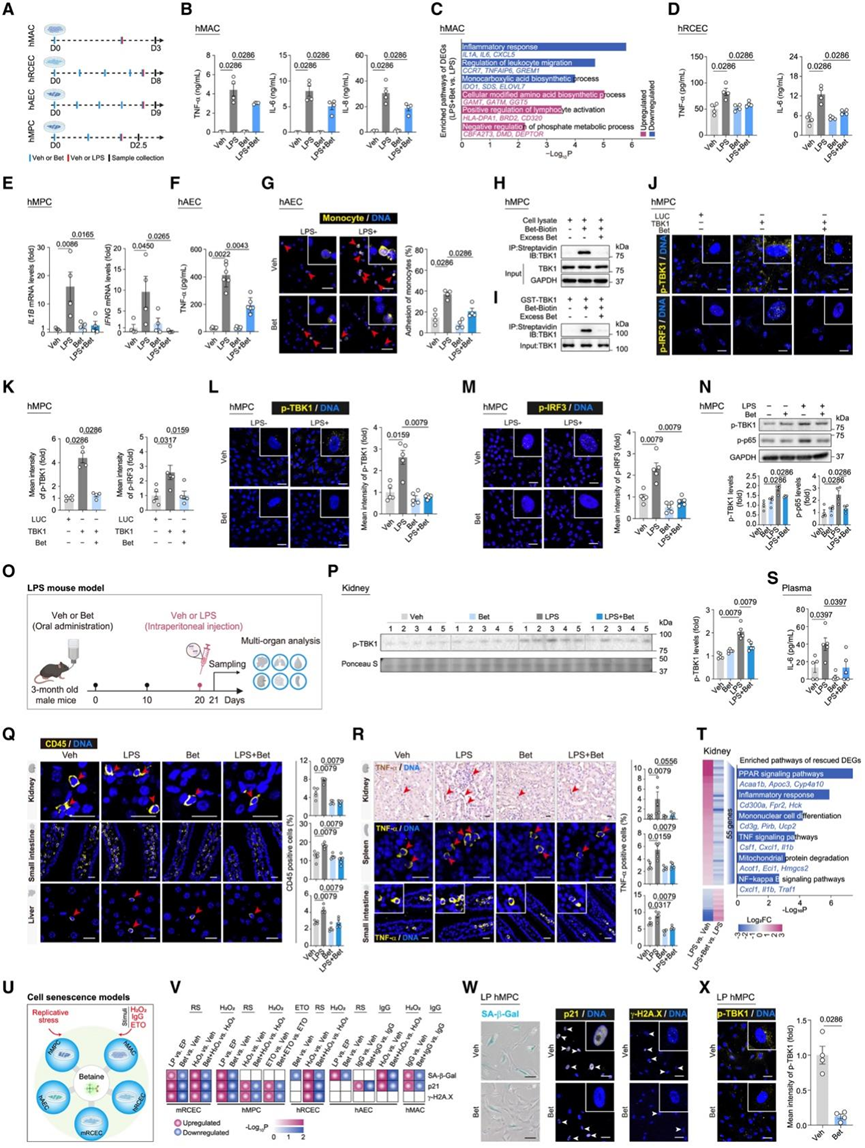
图6. 甜菜碱抑制TBK1活性,延缓衰老和炎症。
(A) 所示细胞中脂多糖(LPS)攻击和甜菜碱(Bet)治疗的示意图。(B) ELISA 检测各组 hMAC 分泌的 TNF-α、IL-6 和 IL-8 水平。(C) hMAC 中 DEG 的富集通路。(D) ELISA 检测各组 hRCEC 分泌的 TNF-α 和 IL-6 水平。(E) 对各组 hMPC 中的IL1B和IFNG mRNA 水平进行 RT-qPCR 分析。(F) ELISA 检测各组 hAEC 分泌的 TNF-α 水平。(G) 各组THP-1单核细胞与hAEC的粘附情况。(H-I)免疫印迹分析。(J-K)免疫染色分析。(L-M) 各组 hMPC 中 p-TBK1和 p-IRF3的免疫染色。(N)免疫印迹分析。(O)实验流程。(P)免疫印迹分析。(Q-R)免疫染色分析。(S) ELISA 检测各组小鼠血浆中的 IL-6 水平。(T) 小鼠肾脏中 Bet 拯救的 LPS 诱导基因的差异倍数(左)和富集通路(右)。(U) 示意图,说明 Bet 治疗在缓解细胞衰老方面的实验流程。(V) 热图显示了不同处理条件下,不同细胞类型中多种衰老指标(SA-β-Gal、p21 和 γ-H2A.X 阳性)的变化。(W-X)免疫染色分析。
07
甜菜碱为各器官提供系统性老年保护
鉴于细胞衰老是生物体衰老的基础,他们接下来研究了甜菜碱补充剂是否可以在系统水平上延缓生物体衰老(图 7 A)。老年小鼠补充 1%(w/v)甜菜碱可使肾脏甜菜碱增加约 2 倍,类似于运动引起的变化。补充甜菜碱不会影响小鼠的基本生理参数,包括食物摄入量、水消耗量、日常活动或心脏功能。然而,接受治疗的小鼠尿肌酐增加,并随着年龄增长而下降,表明肾功能得到改善。此外,甜菜碱干预增加了老年小鼠的呼吸交换率(图 7B),该参数通常也会随着年龄的增长而降低,表明代谢能力提高。甜菜碱给药还增强了骨骼肌稳态,这通过在转棒测试中延长悬挂时间和握力增加趋势来证明(图 7C-D)。此外,它还改善了平衡能力并减少了抑郁样行为(图 7E-F),这些表型会随着年龄的增长而恶化。接受甜菜碱治疗的小鼠在 Y 型迷宫测试中也表现出行进距离增加和总进入次数增加的趋势(图 7G),表明认知能力下降得到了挽救。
值得注意的是,长期口服低剂量(0.1% w/v)甜菜碱可维持老年小鼠的抗衰老活性。多器官组织学染色显示,甜菜碱治疗可缓解多种组织衰老特征,包括减少SA-β-半乳糖苷酶阳性细胞、减少磷酸化p53或p21阳性衰老细胞、减少免疫细胞浸润、减少组织内脂滴积聚以及减轻组织纤维化(图7 H-J)。此外,甜菜碱干预可增加肌纤维横截面积,增厚皮肤基底层(皮肤细胞干细胞的标志物),并减轻肾小球萎缩。在分子水平上,甜菜碱治疗下调了基因组不稳定性标志物 γ-H2A.X 并增加了异染色质稳态,这通过 DNA 甲基化和 H3K9me3 水平升高得到证明(图7 K-L)。同时,小鼠内源性逆转录病毒——小鼠乳腺肿瘤病毒 (MMTV) 的再激活受到抑制。他们还观察到多种组织中脂质过氧化降低、蛋白质稳定性增加和 SASP 因子水平降低。转录组分析进一步证实了甜菜碱在多个器官中的抗衰老作用,其中在肾脏和肌肉中的作用最为明显(图 7 M)。甜菜碱挽救衰老基因的功能富集分析显示,葡萄糖和烟酰胺核苷酸代谢相关基因上调,同时促炎基因下调,特别是通常由 TBK1 激活的干扰素反应通路(图 7 M)。
同时,通过单细胞核转录组分析(snRNA-seq),他们发现甜菜碱可以减轻小鼠肾脏大多数细胞类型的衰老特征,尤其是在肾小管上皮细胞中(图 7 N-O)。随着衰老而减少的昼夜节律基因在甜菜碱干预后得到恢复,而增加的炎症基因则受到抑制(图 7 P)。基因集评分显示,甜菜碱下调了与细胞衰老和 SASP 相关的基因。值得注意的是,随着衰老而上调的 TBK1 激酶底物 IRF3 和 IRF7 的靶基因表达。组织学染色结果一致显示,甜菜碱降低了肾脏TBK1、IRF3和p65的磷酸化,并抑制了促炎因子TNF-α、IL-1β和IL-6的表达(图7 Q-V)。总之,这些结果表明甜菜碱对细胞衰老和系统性衰老具有拮抗作用,支持其作为运动诱导全身性益处的中介因子的作用。
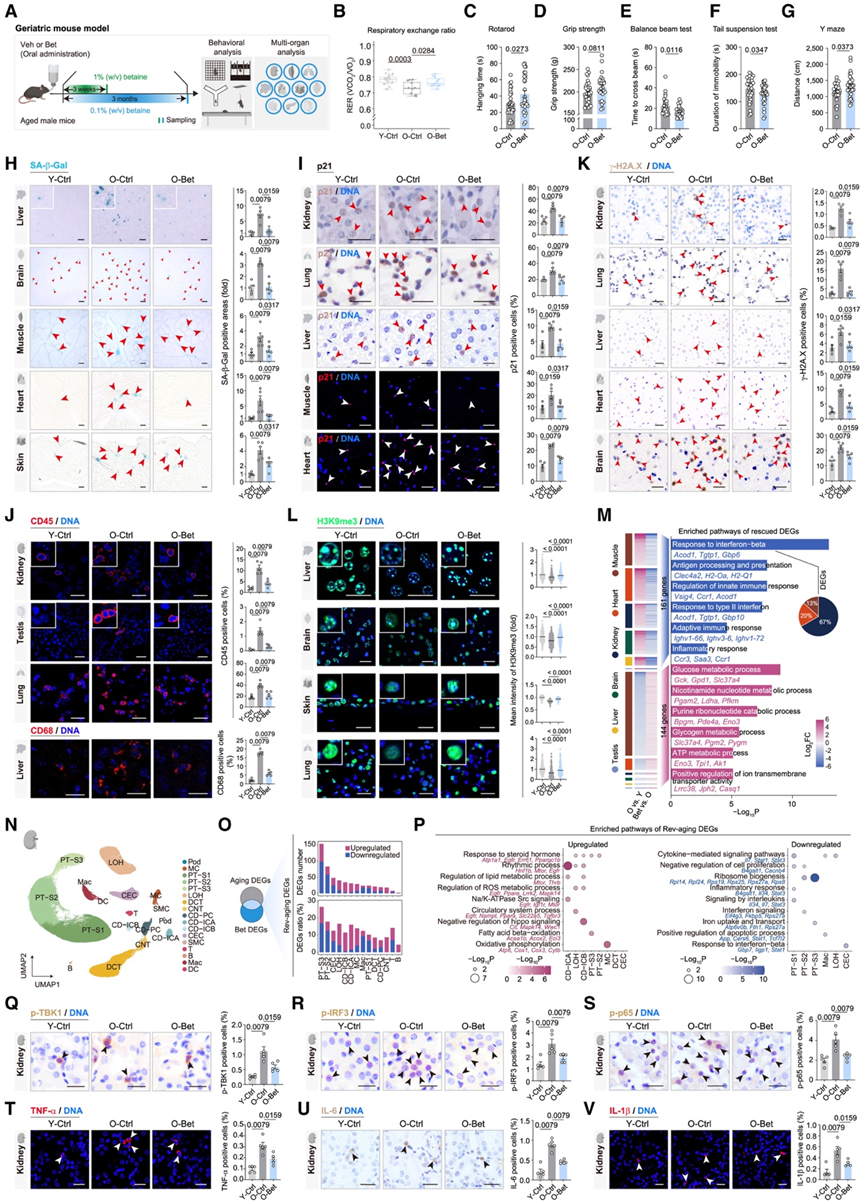
图7. 甜菜碱(Bet)给药可延缓小鼠全身衰老。
(A) 老年小鼠接受 Bet 治疗的两种剂量和时间方案示意图。(B) 箱线图显示了各组小鼠在代谢笼中测得的呼吸交换率变化。(C) O-Ctrl 和 O-Bet 小鼠的旋转悬杆能力评估。(D) O-Ctrl和O-Bet小鼠的握力评估分析。(E) 平衡木测试中 O-Ctrl 和 O-Bet 小鼠穿过平衡木的时间。(F) O-Ctrl 和 O-Bet 小鼠在悬尾试验中的不动持续时间。(G) O-Ctrl 和 O-Bet 小鼠在 Y 型迷宫测试中总行进距离。(H) 对所示小鼠组别的多种组织进行 SA-β-Gal 染色。(I-L)免疫染色分析。(M) 图示组别中不同组织中Bet挽救的年龄相关基因的差异倍数(左)及其相应的富集通路(右)。饼图显示不同组织中对干扰素β相关基因反应的相对比率。(N) UMAP 图显示小鼠肾脏中的细胞组成分布。(O) 左图:基于 snRNA-seq 数据,维恩图显示了衰老 DEG(O-Ctrl 与 Y-Ctrl)和 Bet DEG(O-Bet 与 O-Ctrl)之间的重叠情况。逆转衰老 DEG 是指与衰老 DEG 反向变化的 Bet DEG 子集。右图:小鼠肾脏中不同细胞类型中逆转衰老基因的数量(上图)和比例(下图)。(P) 不同细胞类型中上调(左)和下调(右)Rev-aging 基因的富集通路。(Q-V)免疫染色分析。
+ + + + + + + + + + +
结 论
本项研究进行了一项整合多组学分析,比较了短期和长期运动对健康男性的影响。短期运动会引发短暂性反应,而反复运动则会引发适应性变化,显著减少细胞衰老和炎症,并增强甜菜碱代谢。运动诱导的甜菜碱富集(部分由肾脏生物合成介导)发挥抗衰老作用,并挽救小鼠因年龄相关的健康衰退。甜菜碱与TBK1结合并抑制其表达,从而延缓衰老动力学。这些研究结果系统地阐明了运动的分子益处,并将甜菜碱定位为健康老龄化的运动模拟物。
+ + + + +



 English
English


