文献解读|Cell Rep Med(11.7):患者来源的类器官的代谢分析表明核苷酸合成是恶性横纹肌样瘤的代谢脆弱性
✦ +
+
论文ID
原名:Metabolic profiling of patient-derived organoids reveals nucleotide synthesis as a metabolic vulnerability in malignant rhabdoid tumors
译名:患者来源的类器官的代谢分析表明核苷酸合成是恶性横纹肌样瘤的代谢脆弱性
期刊:Cell Reports Medicine
影响因子:11.7
发表时间:2024.12.20
DOI号:10.1016/j.xcrm.2024.101878
背 景
肾癌是儿童中第二大常见实体癌症。儿童肾脏肿瘤主要包括 Wilms 肿瘤,约占 80%,但也可能出现肾细胞癌 (RCC)、透明细胞肉瘤和恶性横纹肌样瘤。恶性横纹肌样瘤 (MRT) 是一种特别具有侵袭性的恶性肿瘤,通常在幼儿(主要是婴儿)中诊断出来,并且可以在全身发展,包括大脑,在大脑中将它们称为非典型畸胎瘤样/横纹肌样瘤 (AT/RT)。根据DNA甲基化模式和转录组谱,AT/RT 可进一步细分为三个亚组,分别称为 MYC、Sonic Hedgehog (SHH) 和酪氨酸酶 (TYR)。MRT 是由于胎儿发育过程中分化和谱系特化失调而产生的,这是由SMARCB1(约 95% 的病例)或 SMARCA4(约 5% 的病例)的双等位基因失活引起的,它们都是SWItch /蔗糖不可发酵(SWI /SNF) 染色质重塑复合物的亚基。到目前为止,患者的生存依赖于强化治疗方法,包括化疗、放疗和手术干预。然而,在年轻和/或患有转移性疾病的患者中,生存率仍然非常低,凸显了对治疗创新的迫切需求。
实验设计
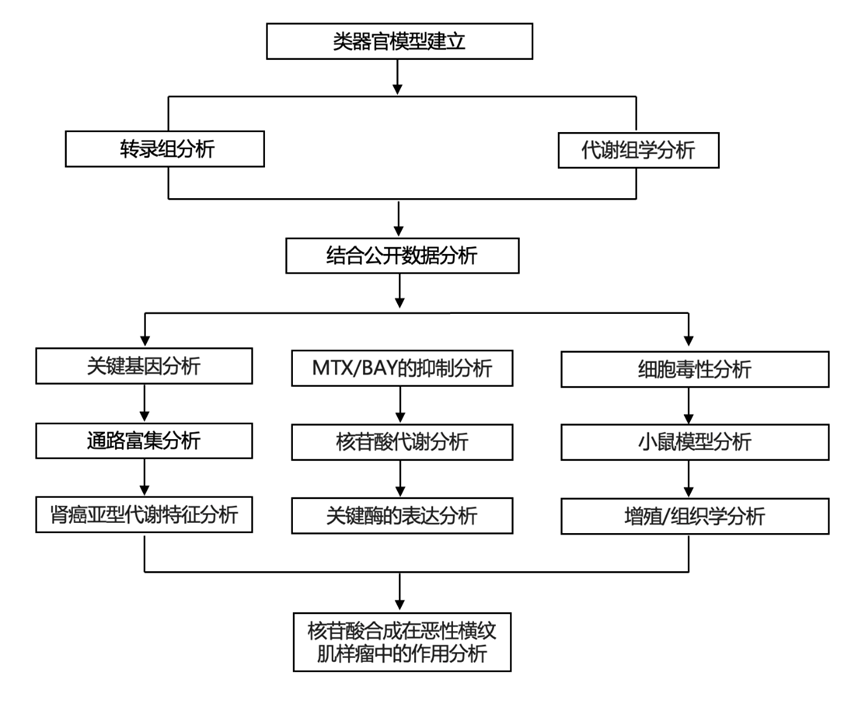
结 果
01
儿童肾肿瘤亚型具有独特的代谢特征
研究开始研究儿童肾肿瘤的代谢特征,通过分析转录组(RNA-seq)基因表达数据集,该数据集包含三种主要肾癌亚型(Wilms 肿瘤、RCC 和肾 MRT)的肿瘤类器官和匹配的肿瘤组织,以及正常的肾脏来源的类器官。专门针对代谢基因的主成分 (PC) 分析表明,肿瘤组织和肿瘤组织基于组织病理学实体聚类(图 1 A),表明肿瘤实体特异性代谢谱在肿瘤组织中基本保留,至少在基因表达水平上是如此。虽然 Wilms 肿瘤显示出更加异质的代谢基因表达模式,但 MRT 组织及其衍生的肿瘤组织代表了一个与其他肾肿瘤实体和正常肾类器官不同的明显聚类(图 1 A)。
为了确定哪些代谢通路调控 MRT 特异性表达谱,他们对前 100 个 MRT 特异性代谢基因进行了GO分析(图 1 B)。MRT 组织和肿瘤类器官显示出参与嘌呤和嘧啶核苷酸生物合成的基因显著富集(图 1 B)。使用基于从头核苷酸生物合成基因 mRNA 表达的无监督层次聚类,他们观察到肿瘤特异性聚类,其中 MRT 表达最高(图1C-D)。另一方面,Wilms 肿瘤显示出参与磷脂代谢的基因显著增加(图 S1 A-B),强调不同的儿童肾肿瘤亚型表现出独特的代谢特征。这些关联得到来自 TARGET 数据库的儿童肾肿瘤组织独立基因表达数据集的证实(图S1C-F)。
为了验证所识别的代谢基因特征是否也会导致代谢物水平差异,他们在 MRT 和 Wilms 肿瘤样细胞以及正常肾脏组织来源的类器官中进行了基于液相色谱-质谱 (LC-MS) 的代谢组学研究(图 1 E)。对所有样本中检测到的代谢物进行无监督层次聚类显示,与正常肾脏类器官相比,MRT 和 Wilms 肿瘤样细胞具有不同的代谢特征。此外,MRT 肿瘤样细胞中参与嘧啶和嘌呤生物合成的代谢物水平最高(二氢乳清酸、N-氨基甲酰天冬氨酸、尿苷单磷酸 [UMP] 和肌苷单磷酸 [IMP]、鸟嘌呤单磷酸 [GMP] 和腺苷单磷酸 [AMP])(图 1 E)。与正常肾脏类器官相比,MRT 肿瘤样细胞中嘌呤和嘧啶代谢物水平升高在后续研究中得到证实并进一步表征(图 S1 G)。另一方面,Wilms肿瘤类器官表现出高水平的三羧酸 (TCA) 循环代谢物。总之,这些数据表明,根据基因表达和代谢物水平儿童肾肿瘤亚型具有不同的代谢特征,其中 MRT 显示核苷酸生物合成增加。
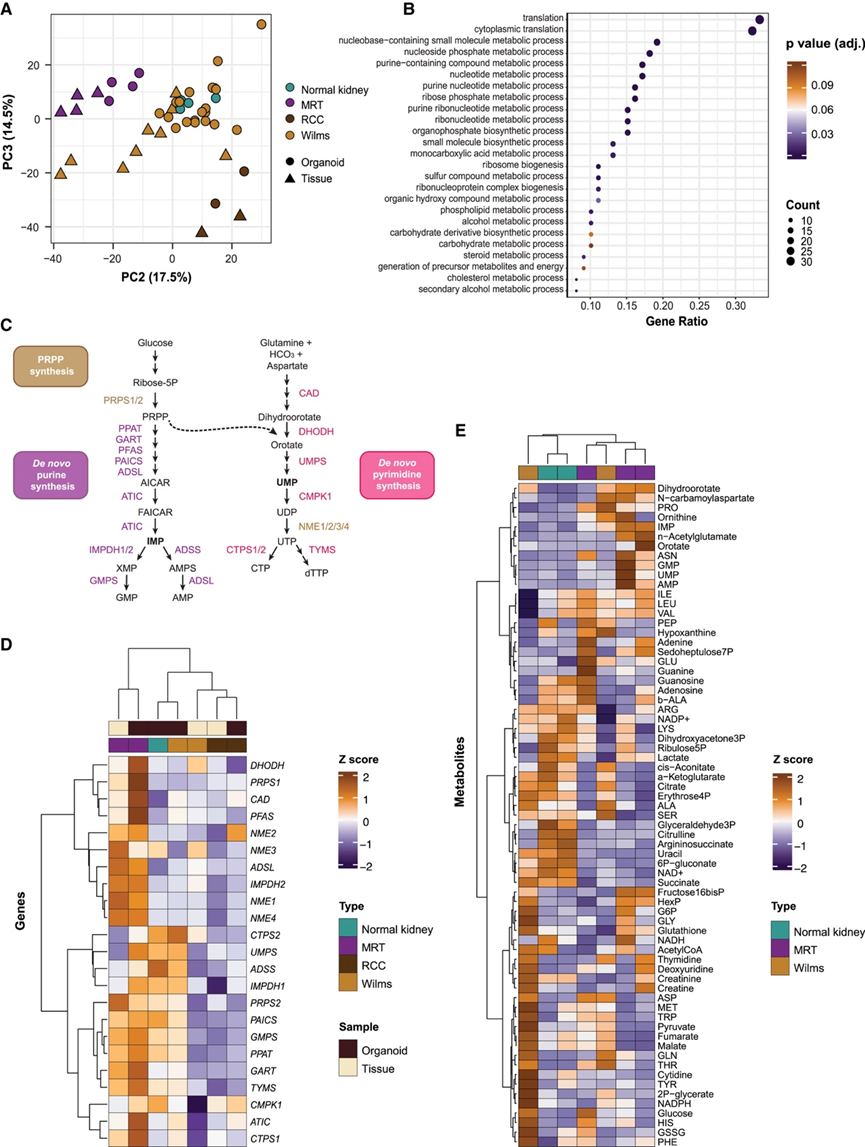
图1. 儿童肾脏肿瘤亚型具有不同的代谢印记。
(A) 对所有n = 45 个样本中的代谢基因的基因表达谱进行无监督主成分 (PC) 分析。(B)GO分析。(C) 嘌呤和嘧啶单磷酸盐生物合成通路的示意图和简化表示。(D) 基于Z分数的热图可视化了每种肾脏样本类型组中嘌呤和嘧啶核苷单磷酸生物合成途径基因的平均表达。(E) 基于Z分数的热图,表示在 24 小时稳态代谢组学研究中检测到的所有肿瘤类器官培养物中检测到的代谢物的层次聚类。
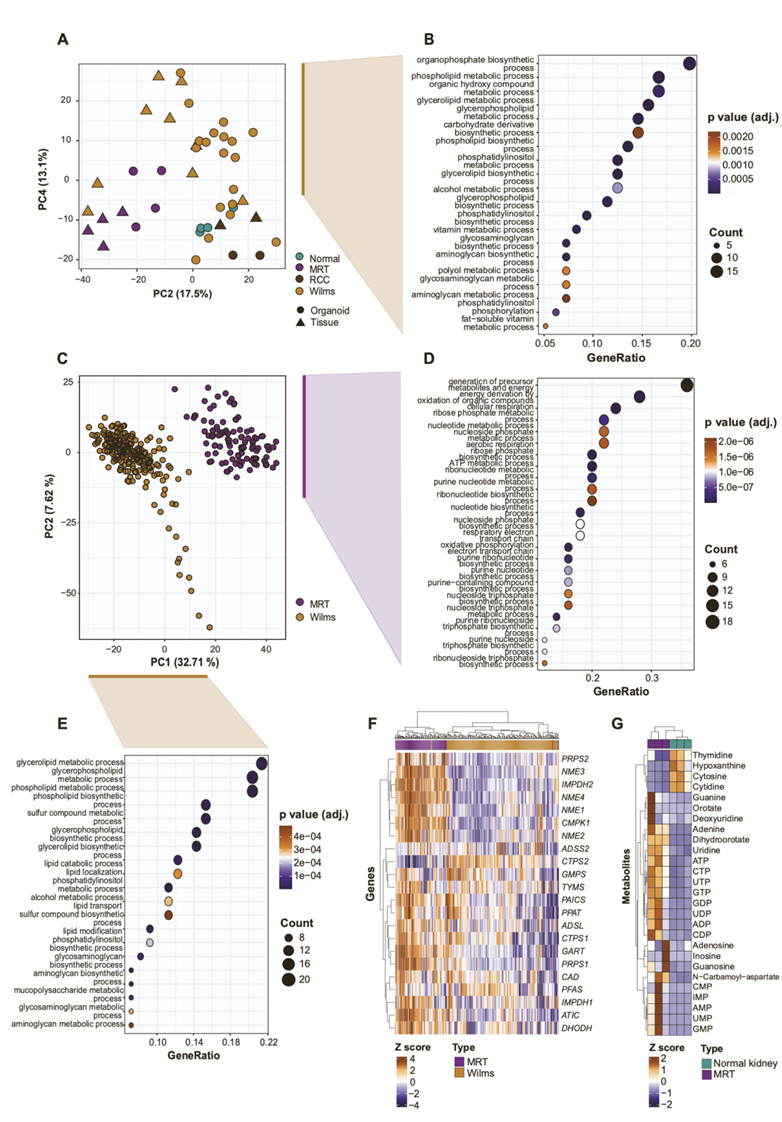
图S1. 利用公开的转录组数据进行验证,证实了肾肿瘤亚型的不同代谢印记。
(A)PCA分析。(B)GO分析。(C) 无监督主成分分析。(D-E) GO分析。(F) 基于z分数的热图显示了参与嘌呤和嘧啶生物合成的基因的表达每个肾样本类型的通路。(G) 在24小时稳态代谢组学研究后,基于z评分的热图代表了在指定的肿瘤类器官培养参考标准中包含的所有嘌呤和嘧啶代谢物的层次聚类。
02
抑制核苷酸从头合成
为了研究 MRT 中观察到的核苷酸代谢增加是否代表 ecMRT 或一般横纹肌瘤的假定治疗靶点,他们开始在一系列横纹肌瘤和非横纹肌瘤模型中药理学抑制这些通路。甲氨蝶呤 (MTX) 通过多种机制干扰嘌呤核苷酸和胸苷酸的合成(图2 A),并在临床上广泛用于治疗不同类型的癌症。BAY -2402234 (BAY,Orludodstat) 是嘧啶从头合成酶 DHODH的有效抑制剂(图 2 A)。最近,BAY 在各种脑肿瘤中显示出有希望的临床前结果。因此,他们用不同浓度的 MTX 和 BAY 治疗了三种 MRT 和六种 AT/RT 横纹肌样瘤模型(三种 AT/RT-SHH 和三种 AT/RT-MYC 41)。正常肾类器官以及来自其他肿瘤实体(例如横纹肌肉瘤 (RMS) 和 Wilms 肿瘤)的肿瘤类器官也包括在内。与正常肾类器官、RMS 和 Wilms 肿瘤相比(图 2 B-D 和图 S2 A-E),所有测试的 MRT 和 AT/RT 肿瘤对 MTX 治疗的敏感性明显更高。虽然 MTX 在横纹肌样瘤中的平均 IC 50值为 24.6 nM (±13.4),但大多数正常肾脏、RMS 和 Wilms 肿瘤类器官未达到 MTX 的 50% 抑制率(图 2D)。使用 MRT、AT/RT 和 RMS 进行 BAY 治疗后观察到更加不均匀的反应,始终表现出非常高的敏感性,IC 50值在纳摩尔范围内(平均 IC 50值:分别为 4.7 nM [±1.4]、6.1 nM [±3.8] 和 7.8 nM [±8.8]),而正常肾脏类器官和 Wilms 肿瘤类器官表现出较低且更易变的敏感性(图 2C-E,图S2C-E)。接下来,他们对 MRT 肿瘤样细胞和正常肾类器官进行 Annexin V/DAPI 标记,以确定观察到的抑制作用是细胞毒性还是细胞抑制性。治疗正常肾类器官不会诱导任何显著的细胞凋亡。相反,在用 MTX(2.7 倍 [±0.56] 变化)或 BAY(2.5 倍 [±0.40] 变化)治疗后,可以在 MRT 肿瘤样细胞中观察到早期和晚期凋亡细胞显著增加(图 2F-G、图S2F-G)。总之,这些结果表明,靶向核苷酸代谢标志着一种治疗 MRT 的手段。
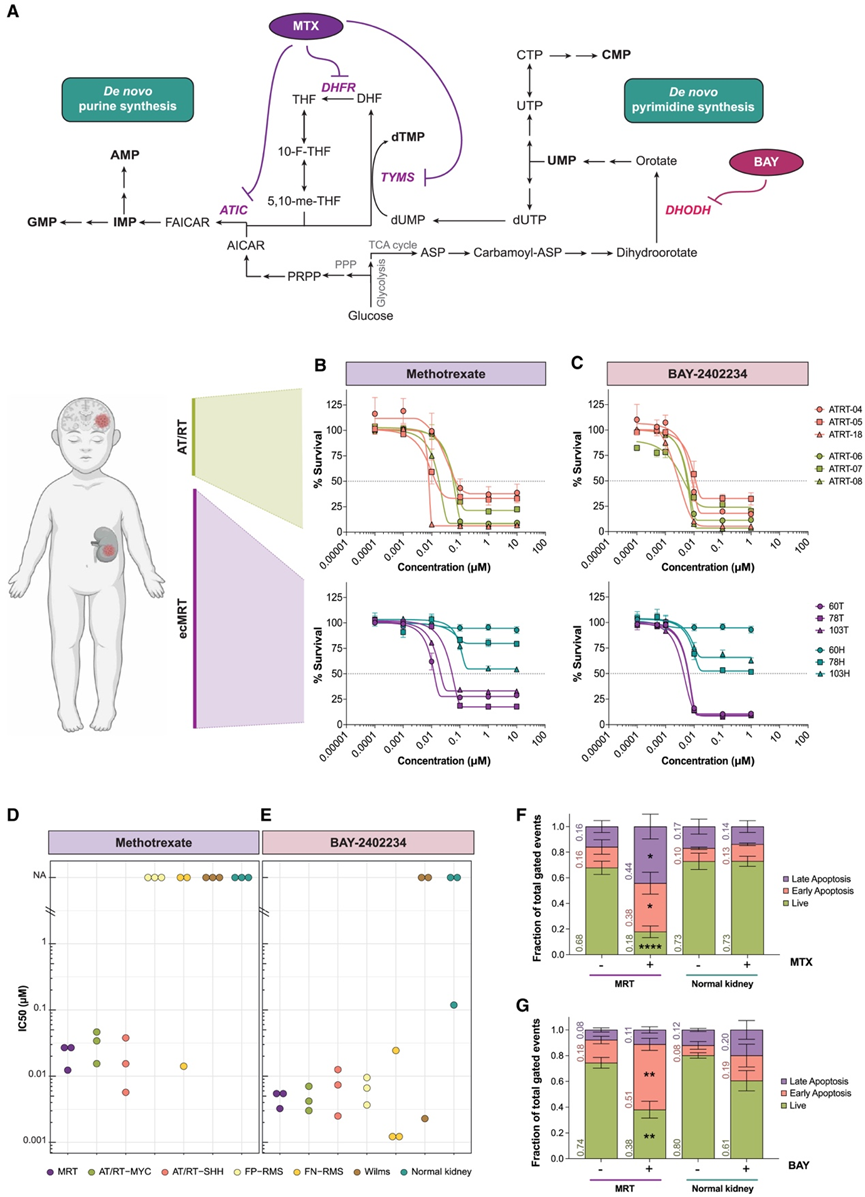
图2.核苷酸从头合成是横纹肌瘤的治疗靶点。
(A) 甲氨蝶呤 (MTX) 和 BAY-2402234 (BAY) 作用机制示意图。(B-C) 所示肿瘤类器官培养物中 MTX和 BAY的剂量反应曲线。(D-E) 散点图显示不同肿瘤和类器官模型中 MTX 和 BAY 的各自 IC 50值。(F-G) 条形图表示用 400 nM MTX (F) 或 50 nM BAY (G) 处理 120 小时后 MRT 和正常肾类器官的活细胞、早期凋亡细胞和晚期凋亡细胞分数。
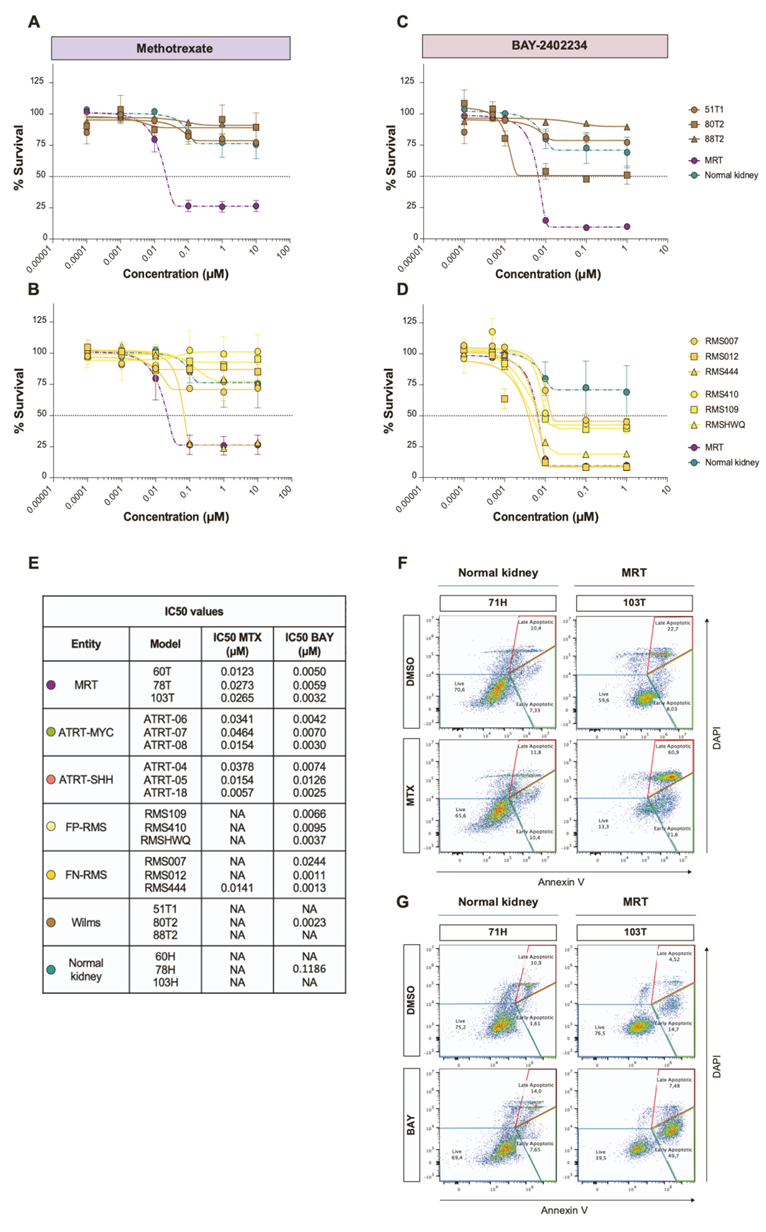
图S2. MTX和BAY治疗横纹肌样肿瘤显示细胞毒性作用。
(A-D) MTX和BAY的剂量反应曲线。(E) 概述MTX和BAY对每个肿瘤和类器官模型的确切IC50值。(F) 用二甲基亚砜(DMSO)或400 nM MTX或DMSO或50 nM BAY处理MRT和正常肾类器官细胞系120
03
MTX 和 BAY 抑制MRT 中的从头核苷酸生物合成
为了进一步分析 MRT 中的核苷酸代谢,他们优化了之前在正常肾类器官和肿瘤模型中建立的同位素示踪工作流程 。MRT 肿瘤类器官和正常肾类器官在 [U- 13C6]-葡萄糖存在下生长,之后使用LC - MS 监测核苷酸中13C碳随时间的掺入。这些结果表明,MRT 主要利用葡萄糖产生参与糖酵解、TCA 循环、戊糖磷酸途径 (PPP)、氧化过程和核苷酸生物合成途径的代谢物。此外,在甲基化相关代谢物 S-腺苷酸同型半胱氨酸和 S-腺苷酸蛋氨酸以及氨基酸丙氨酸、天冬氨酸 (ASP)、谷氨酸和丝氨酸中检测到大量标记葡萄糖的掺入,其中大多数在从头核苷酸合成中起关键作用。正如预期的那样,九种必需氨基酸(HIS、ILE、LEU、LYS、MET、PHE、THR、TRP 和 VAL)不能由人体细胞内源合成,因此仍未标记(图 S3 A)。
着眼于核苷酸的产生,葡萄糖衍生的碳通过几种途径为嘌呤(例如,IMP)和嘧啶(例如,UMP)做出贡献(图 3 A),其中从头合成和补救途径产生不同的同位素。PPP 生成核糖-5-磷酸,从而为嘌呤和嘧啶提供戊糖 ([M+5])。丝氨酸合成途径 (SSP) 提供甘氨酸 ([M+2]) 和 10-甲酰四氢叶酸 (10-F-THF,[M+1]),将它们掺入嘌呤核碱基中,而通过 TCA 循环产生的天冬氨酸 ([M+3]) 为嘧啶核碱基贡献碳。因此,嘌呤和嘧啶的从头合成可产生具有 1-9 个标记碳([M+1–9])的同位素异形体,而在核苷酸回收过程中仅标记核糖部分,从而仅产生 [M+5] 同位素异形体。与正常肾类器官相比,MRT 中的总核苷酸水平更高,以 ADP(嘌呤)和 UDP(嘧啶)为例(图 3 B)。此外,虽然在正常肾类器官中仅存在 ADP 和 UDP [M+0] 和 [M+5],但 MRT 肿瘤样细胞显示 ADP 和 UDP [M+6–8] 的扩增水平,表明核苷酸的从头合成增加(图 3 B)。在核苷酸生物合成途径的最终产物核苷酸单磷酸酯中观察到了类似的标记模式。研究核苷酸中13C 标记的比例随时间的变化,MRT 显示 [M+5] ADP 和 UDP 的产生速度明显加快(即核糖部分的标记),24 小时后达到与正常肾类器官相同水平的平台期(图 3C)。此外,MRT 肿瘤样中高于 [M+5] 的同位素体总比例随时间增加,但在正常肾类器官中却不存在。这些结果在 AT/RT 肿瘤样中得到了重现,其中 [U-13C6]-葡萄糖衍生的碳以与 MRT 相当的速率掺入 ADP 和 UDP,并且也产生了 ADP 和 UDP [M+>5](图S3B-D)。总之,这些发现表明,与正常肾脏类器官相比, MRT 和 AT/RT 肿瘤模型显示出增加的从头核苷酸生物合成。
已知 MTX 通过作用于二氢叶酸还原酶 (DHFR) 来抑制从头嘌呤合成,而二氢叶酸还原酶参与一碳/叶酸代谢。另一方面,BAY 是 DHODH 的特异性抑制剂,DHODH 是一种参与从头嘧啶合成的酶(图 2 A,图3 A)。为了研究 MTX 和 BAY 对葡萄糖依赖性代谢途径(特别是从头核苷酸合成)的影响,他们在存在和不存在 MTX 或 BAY 的情况下在 MRT 类器官中进行了 [U-13C6]-葡萄糖示踪。他们重点关注标记 24 小时后表现出 ≥40% 葡萄糖掺入的代谢物,与 MTX相比,用 BAY 处理(图 S3 F)对 [U-13C6]-葡萄糖掺入葡萄糖依赖性代谢物的影响(图 S3E)更为广泛,且主要表现为抑制作用。最明显的改变出现在核苷酸生物合成通路、氨基酸和 TCA 循环中,而糖酵解代谢物的变化很小甚至没有变化(图 S3E-F)。虽然 MTX 引起的葡萄糖分数掺入变化较小,但最显著的变化出现在与核苷酸合成途径相关的代谢物中(图 S3 E)。除了减少葡萄糖掺入核苷酸外,MTX 还降低了嘌呤的总水平,特别是 [M>+5] 部分(图 3 D)。经 BAY 处理后,所有 UDP 同位素体的水平显著下降,表明嘧啶合成受到抑制(图 3 E)。正如预期的那样,BAY 处理还导致 DHODH 上游代谢物(如天冬氨酸和氨基甲酰天冬氨酸)的积累,以及其下游代谢物乳清酸的水平降低(图 S3 G)。
为了证实 MTX 和 BAY 在转录水平上的代谢影响,他们着手研究这些药物对核苷酸从头合成途径中关键酶表达的影响。因此,他们对暴露于 DMSO、MTX 或 BAY 的患者匹配的 MRT 肿瘤样细胞和正常肾类器官进行了转录组分析。与之前的结果一致(图 1 D),与正常肾类器官相比,MRT 显示出更高的核苷酸从头生物合成基因表达水平(图 S3 H)。用 MTX 和 BAY 治疗特异性地诱导了 MRT 中大多数核苷酸生物合成基因的下调(图 S3 I-J)。值得注意的是,BAY 治疗有效地将 MRT 中其直接靶标 DHODH 的表达水平恢复到与基线时正常肾类器官相当的水平(图 S3 K)。这些结果验证了 MTX 和 BAY 在转录水平上的代谢作用,并表明 MRT 对核苷酸生物合成抑制的特异性敏感性至少部分归因于与正常肾类器官相比,MRT 肿瘤类器官中关键酶的基线表达更高。
为了进一步证实 MTX 和 BAY 对 MRT 的细胞毒性是由药物的靶向作用引起的,他们通过在药物治疗期间补充亚叶酸 (FA) 或核苷进行了挽救实验(图 3F)。FA 和核苷都完全挽救了 MTX 诱导的细胞死亡(图 3G),而只有核苷补充挽救了 BAY 诱导的细胞死亡(图 3H),这符合两种药物对核苷生物合成途径的作用机制。总之,这些结果证实 MTX 和 BAY 通过抑制从头核苷酸合成来诱导 MRT 中的细胞死亡。
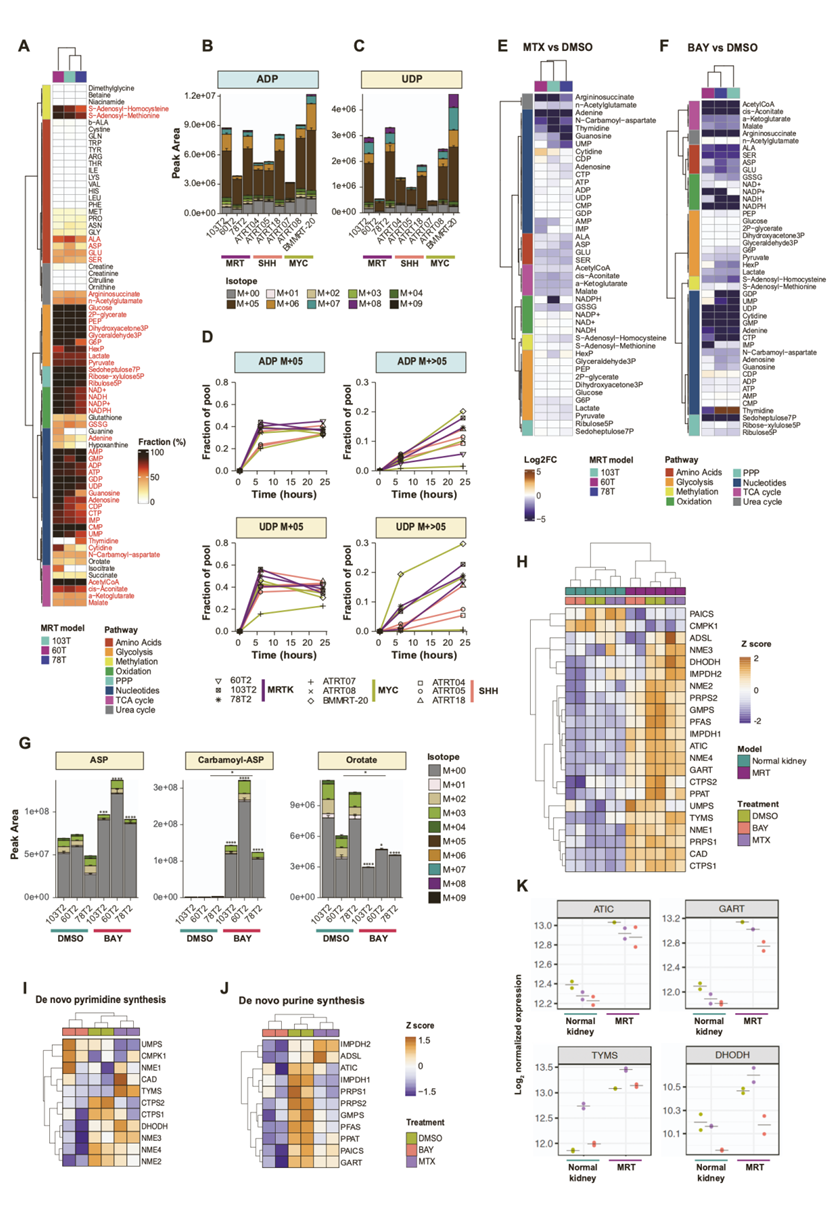
图S3. 横纹肌样肿瘤模型中高水平的核苷酸生物合成。
(A) 热图显示葡萄糖并入单个代谢物的百分比。(B-C) 同位素分布。(D) 葡萄糖来源的13C在ADP和UDP中的掺入。(E-F) 热图显示MTX和BAY处理的MRT肿瘤中13C标记的代谢物部分的变化。(G) 三种MRT中天冬氨酸(ASP)、氨甲酰-ASP和旋合酸的同位素分布。(H) 基于z分数的热图可视化参与从头核苷酸生物合成途径的基因表达。(I-J) 基于z-评分的热图显示了参与从头嘧啶生物合成和从头嘌呤生物合成途径的基因表达。(K) 点图显示MTX的直接靶点(ATIC、GART、TYMS)和BAY(DHODH)的标准化基因表达。
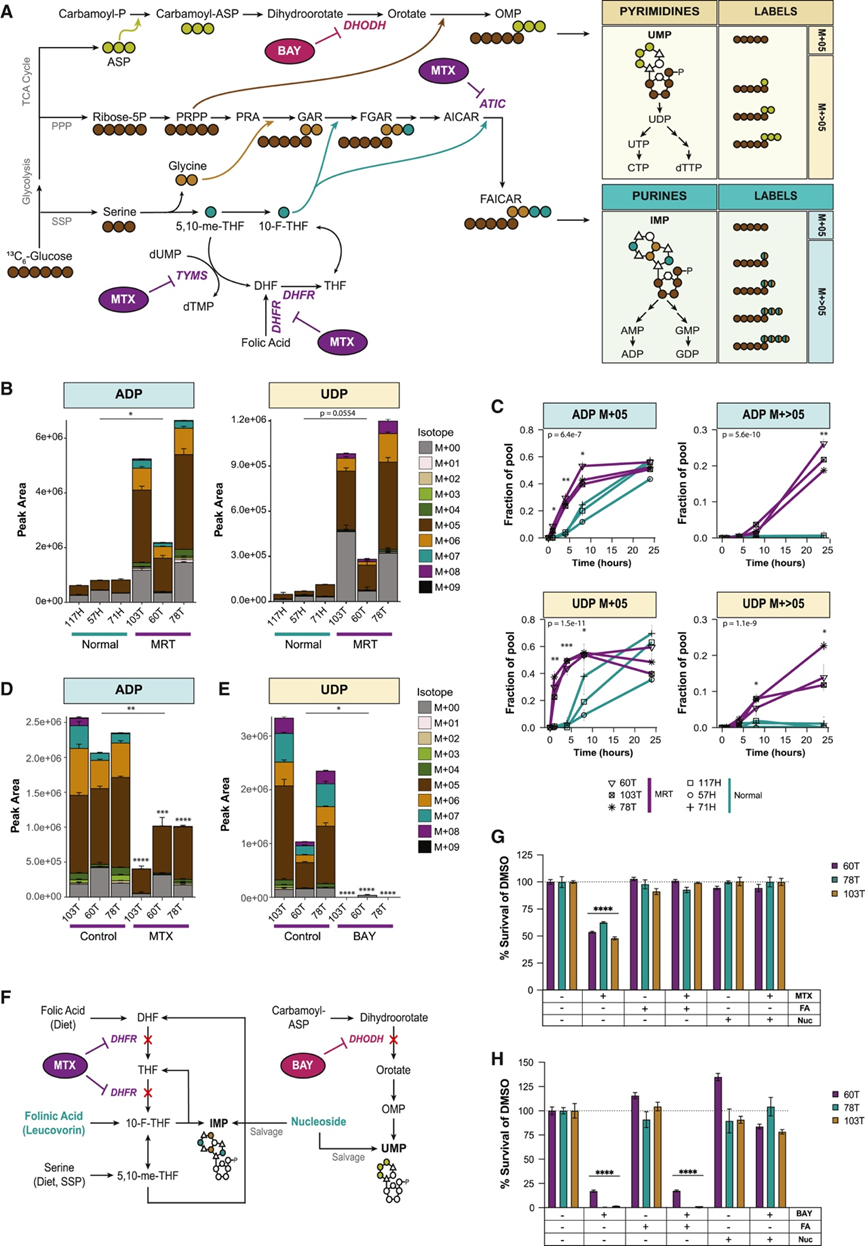
图3. MTX 和 BAY 通过抑制从头核苷酸生物合成靶向 MRT。
(A) [U-13C6 ]-葡萄糖中的碳掺入嘌呤和嘧啶的示意图。(B) 同位素分布。(C) 在[U-13C6 ]-葡萄糖中培养 24 小时后,三种正常肾脏类器官(蓝色)和三种 MRT 肿瘤类器官(紫色)中葡萄糖衍生的13C随时间在 ADP 和 UDP 中的掺入情况。(D-E) 同位素分布。(F) 图形表示亚叶酸和核苷挽救 MTX 和 BAY 作用的机制。(G-H) 条形图显示用 400 nM MTX 或 50 nM BAY 单独处理和与核苷或亚叶酸联合处理 120 小时后三种 MRT 类器官系的活力。
04
MTX 抑制体内MRT 生长
由于 MTX 已在临床上广泛用于抗癌治疗,他们接下来旨在研究 MTX 是否可以抑制体内MRT 的生长。为了防止叶酸(通常小鼠食物中含量较高)抵消 MTX 的功效,所有小鼠在治疗期间均采用不含叶酸的饮食。为此,免疫缺陷的非肥胖糖尿病 (NOD)-严重联合免疫缺陷 (SCID) IL2Rgnull 小鼠皮下注射 MRT 肿瘤样细胞,产生组织学上类似于原发性 MRT 组织的肿瘤(图 S4 A)。当肿瘤体积达到 100-150 mm3 时,小鼠转为采用不含叶酸的饮食。节食一周后,对小鼠进行每日腹膜内 (ip) 注射 0.75 mg/kg MTX(由之前的最大耐受剂量研究确定)或载体(盐水),持续四周(图 4 A)。
与 103T MRT 模型相比(图 4 B-F),78T MRT 模型表现出体内生长加速(图 4 C-G)。根据两种 PDX 模型之间的生长动力学差异,小鼠接受 MTX 治疗 21 天 (78T) 或 28 天 (103T)。与体外观察结果一致,与接受盐水治疗的小鼠相比,MTX 治疗导致 MRT 肿瘤生长延迟和增殖减少(图 4 B-4G)。然而,体重测量确实显示出与 MTX 相关的毒性迹象,显示一些接受 MTX 治疗的小鼠体重减轻超过 20%。虽然存在相关毒性,但每日使用 MTX 治疗可有效延缓体内MRT 的生长并减少其增殖,这与体外观察结果一致。
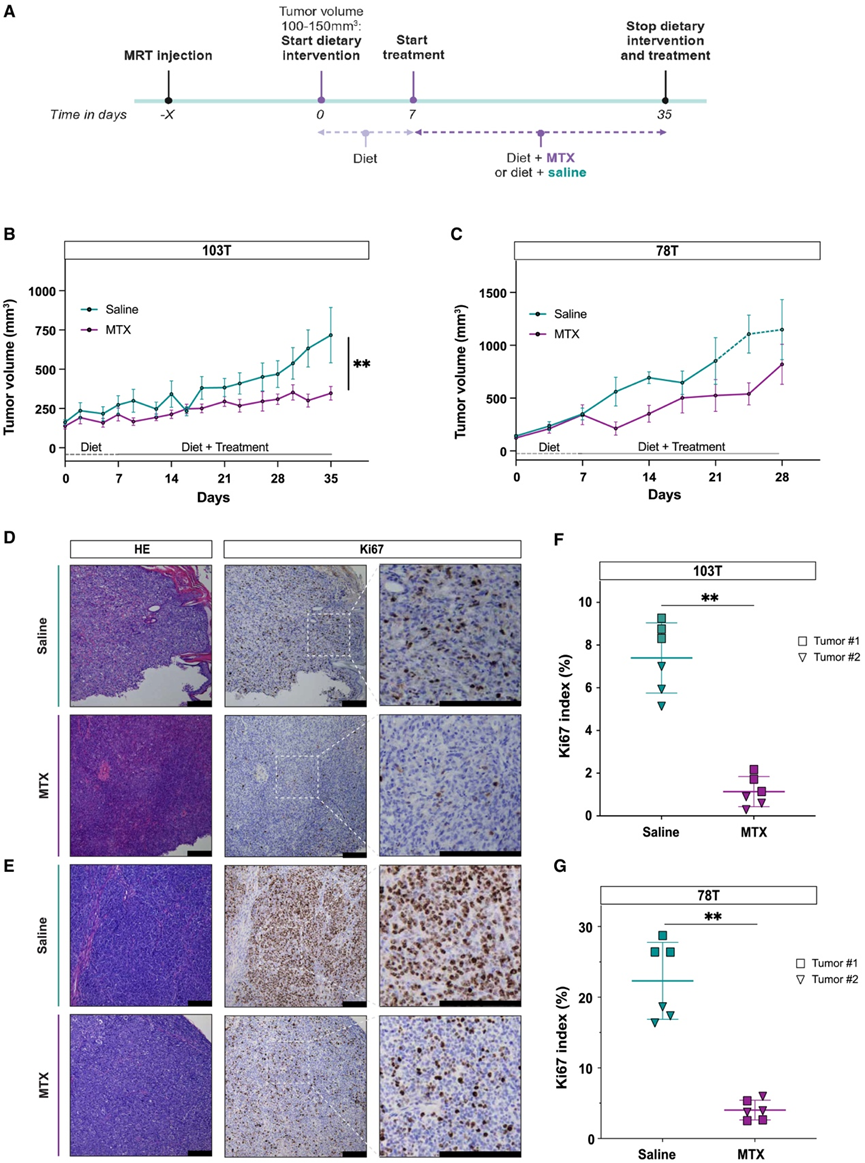
图4. 甲氨蝶呤在 MRT 异种移植模型中表现出体内疗效。
(A)体内MTX 测试的实验概述。(B-C) 肿瘤生长情况。(D-E) 苏木精和伊红 (HE) 和 Ki67 染色。(F-G) 散点图显示来自 MRT PDX 模型 103T和 78T的盐水载体处理(蓝色)和 MTX 处理(紫色)肿瘤组织中的 Ki67 标记指数。
+ + + + + + + + + + +
结 论
本研究使用患者来源的肿瘤类器官来分析几种儿童癌症的代谢图谱。结合基因表达分析和使用质谱的代谢物分析,发现核苷酸生物合成是 MRT 的一个特殊靶点。使用从头核苷酸合成抑制剂甲氨蝶呤 (MTX) 和 BAY-2402234 治疗 MRT 肿瘤类可降低 MRT 肿瘤类中的核苷酸水平并诱导细胞凋亡。最后,本研究证明了MTX 在 MRT 患者来源的异种移植小鼠模型中的体内疗效,表明核苷酸生物合成是 MRT 特异性靶点,这可以为患有这种致命的儿科恶性肿瘤的儿童提供更好的治疗选择。
+ + + + +



 English
English


