文献解读|Nat Commun(14.7):胶质瘤的蛋白质组学分析揭示了免疫和代谢驱动的亚型,这对抗核苷酸代谢治疗有重要意义
✦ +
+
论文ID
原名:Proteomic profiling of gliomas unveils immune and metabolism-driven subtypes with implications for anti-nucleotide metabolism therapy
译名:胶质瘤的蛋白质组学分析揭示了免疫和代谢驱动的亚型,这对抗核苷酸代谢治疗有重要意义
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.19
DOI号:10.1038/s41467-024-54352-5
背 景
胶质瘤约占所有原发性中枢神经系统 (CNS) 恶性肿瘤的 81%,是最常见的内在性脑肿瘤类型,异质性高,预后差。虽然在基因组和转录组水平上取得了实质性进展,但全面的蛋白质组学表征及其含义仍未得到充分探索。
实验设计
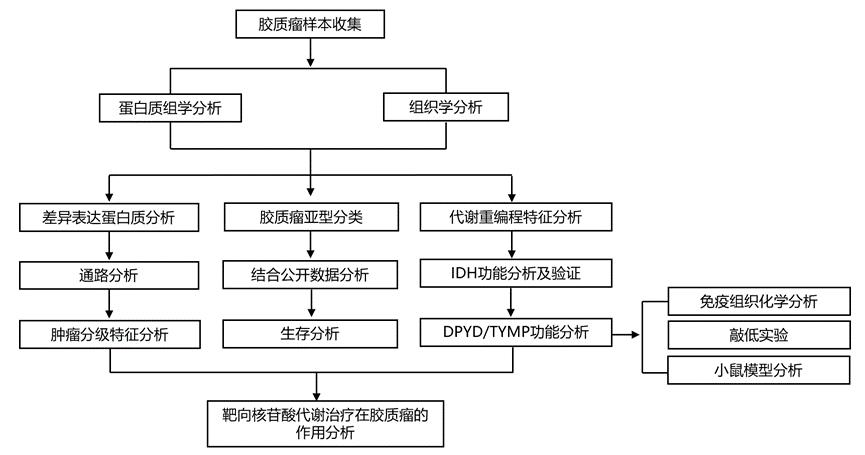
结 果
01
胶质瘤蛋白质组学分析概述
本研究使用来自 188 名胶质瘤患者队列的 343 个肿瘤样本和 53 个正常脑样本进行蛋白质组学分析,其中包括 6 例毛细胞星形细胞瘤、51 例弥漫性星形细胞瘤(27 例 WHO 2 级、14 例 3 级、9 例 4 级、1 例 NA 级)、47 例弥漫性少突胶质细胞瘤(28 例 WHO 2 级、19 例 3 级)、82 例胶质母细胞瘤(WHO 4 级)和 2 例未分类(图1)。切除肿瘤的患者的中位年龄为 49.03 ± 14.48 岁(范围:13-84 岁),男女比例为 1.76:1(男性:N = 120;女性:N = 68)。肿瘤主要位于额叶(99 例)和颞叶(46 例)。研究从华山医院病理科获得了 129 个样本的分子病理学报告。这些报告详细说明了异柠檬酸脱氢酶 (IDH)突变、O6-烷基鸟嘌呤 DNA 烷基转移酶 (MGMT) 启动子甲基化、1p/19q 共缺失和端粒酶逆转录酶启动子突变的状态。其余 59 份样本仅进行了免疫组织化学检测,部分标志物状态未知。截至 2019 年 9 月最后一次随访,58 名患者(30.8%)已去世,127 名患者(76.6%)仍存活,3 名患者(1.6%)未参加随访。最后一次随访中存活患者的中位随访时间为 26.7 个月。
研究显示 570 种蛋白质具有显著的差异表达(图 2A),利用 Ingenuity 通路分析 (IPA),他们发现神经胶质瘤样本中与神经传递、突触形成、神经炎症、肿瘤坏死和 PD-1 信号通路相关的蛋白质富集,表明神经元和免疫相关蛋白的重要作用(图 2B)。最近的研究报告称,神经元与神经胶质瘤细胞的相互作用可直接刺激进展和复发,并激活 WNT/PCP 通路和 BRAF 激酶。认识到改变的细胞代谢作为微环境中神经胶质瘤细胞和免疫细胞之间的通讯界面的重要性,他们随后的重点集中在与免疫调节和代谢过程相关的蛋白质上。在神经胶质瘤和正常脑组织之间的 570 种差异表达蛋白质中,他们鉴定出 28 种免疫相关蛋白质和 51 种代谢相关蛋白质(图 2C)。值得注意的是,据报道,代谢相关蛋白 GPX7 和 SOAT1 在肿瘤中显著上调,可导致神经胶质瘤预后不良并参与免疫调节过程。例如,SOAT1的表达与Treg的浸润呈正相关的趋势,而GPX7可能参与低级别胶质瘤的天然免疫和适应性免疫机制、I型干扰素的产生以及突触传递的调控。
除了正常的大脑和神经胶质瘤组织之间存在明显的蛋白质差异之外,他们还注意到不同等级以及 LGG 和 GBM 之间的神经胶质瘤蛋白质表达存在差异。t-SNE 图直观地描绘了这些不同类别之间的区别(图S3A-C)。关于组织学类型,热图清楚地说明了不同组织学类型的神经胶质瘤中差异表达的蛋白质如何分为两个不同的聚类(图S3D)。聚类 1 在与蛋白质翻译相关的通路(例如 eIF2 和 eIF4)中表现出显著富集,而聚类 2 在与突触合成和信号转导途径相关的途径中明显富集(图S3E-F)。此外,这两个聚类之间的代谢途径(例如氨基酸、核苷酸和脂质代谢)存在明显区别(图S3G-H)。还观察到两组之间不同的代谢途径,如氨基酸、核苷酸和脂质代谢(图S3G-H)。
为了发现在不同等级的胶质瘤中导致肿瘤进展的关键蛋白质,他们在WHO 1-4级胶质瘤中鉴定了1047种差异表达蛋白质。值得注意的是,这些与免疫和代谢过程相关的蛋白质显示出相当大的丰度(图2D)。随着肿瘤等级的增加,免疫和代谢相关蛋白质可聚集成四个具有不同表达趋势的聚类(图S3I-J)。它们主要富集在与核苷酸合成、抗原呈递、干扰素途径和TGF-β相关的通路中,表明胶质瘤细胞的代谢特征与免疫微环境之间存在错综复杂的相互作用(图 2E)。研究表明肿瘤代谢和免疫反应通过免疫代谢重组发生相互影响,这表明探索胶质瘤中免疫和代谢之间的关系值得研究。
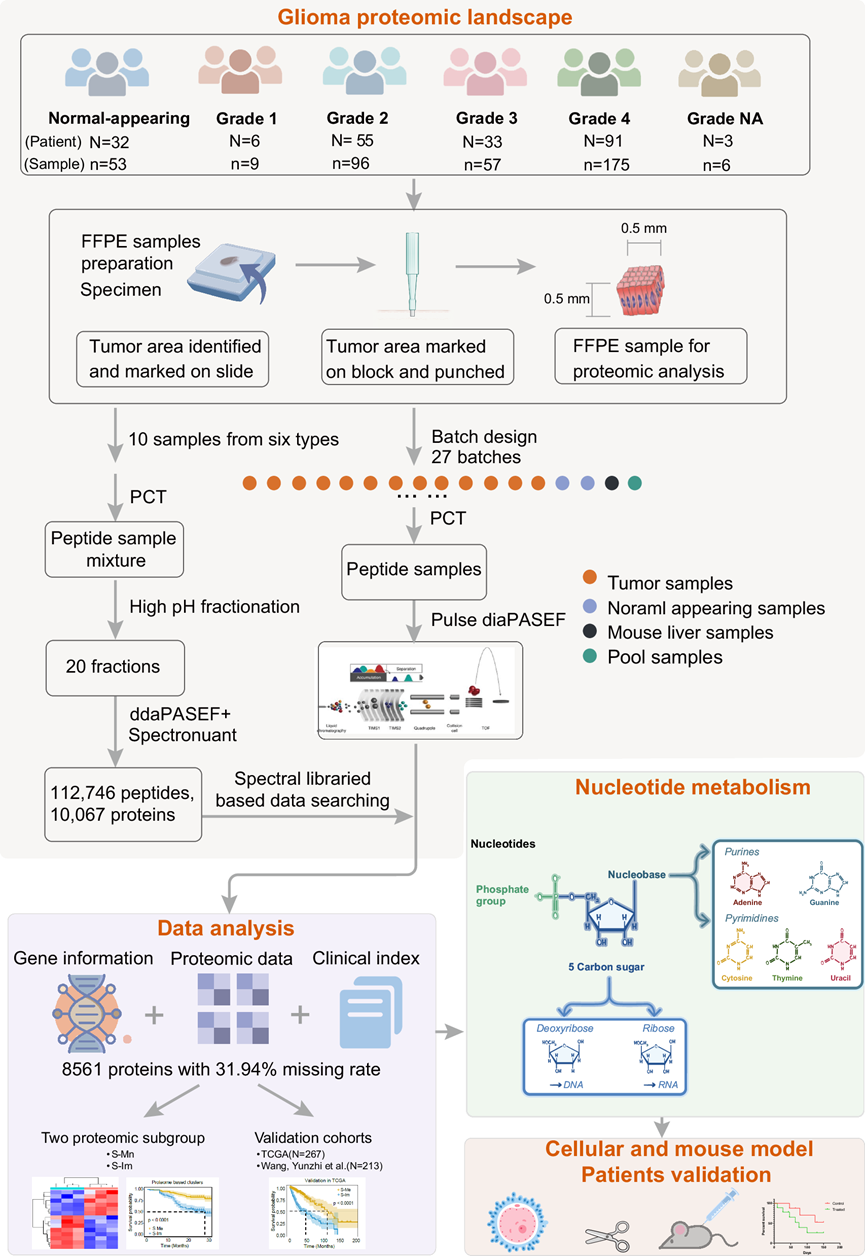
图1. 胶质瘤蛋白质组学分析概述。
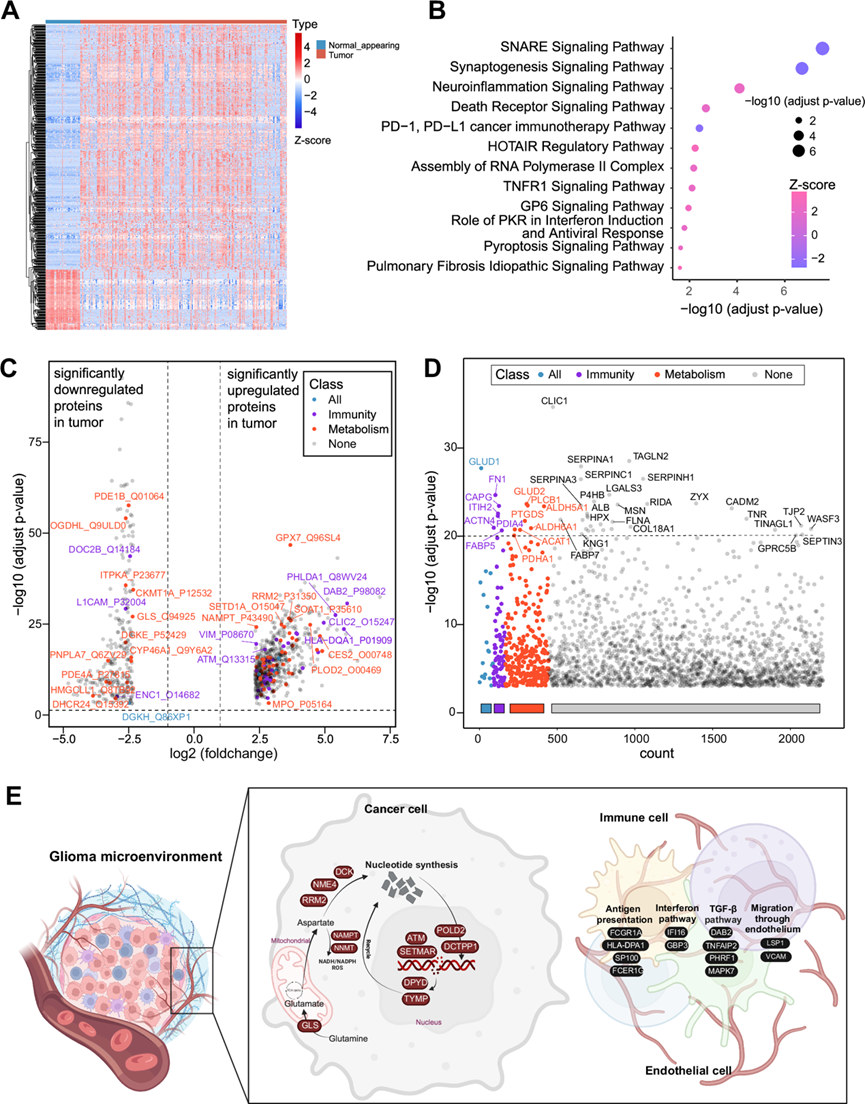
图2. 不同胶质瘤临床分类的蛋白质组学特征各有不同。
(A) 热图显示了 343 个肿瘤样本和 53 个正常脑样本之间的 570 种差异表达蛋白质。(B) 显著富集通路分析。(C) 火山图显示了 343 个肿瘤和 53 个正常脑样本之间的 570 种差异表达蛋白质。(D) 曼哈顿图显示四个等级的 1047 种差异表达蛋白质。(E) 展示了丰富的免疫和代谢过程,包括核苷酸合成、抗原呈递、干扰素信号传导和 TGF-β 通路。
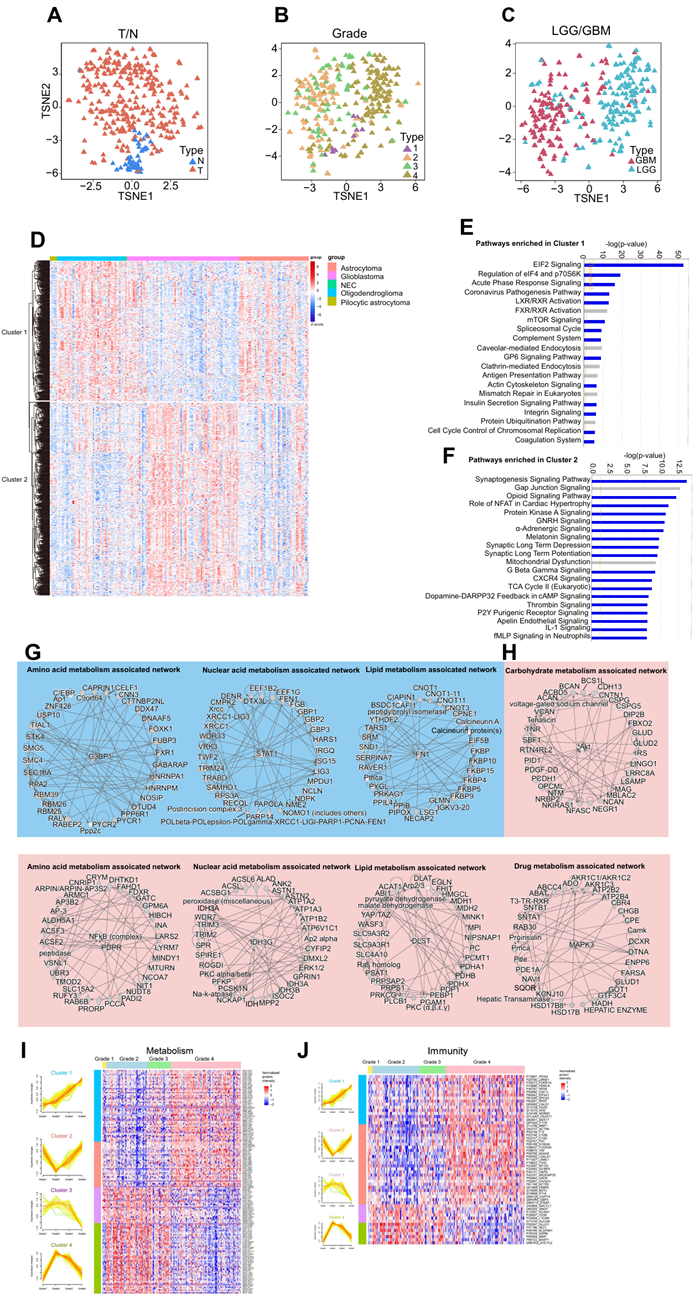
图S3. 基于临床分类的蛋白质组学数据差异。
(A-C) tSNE图显示了样本和肿瘤类型之间的差异。(D) 热图显示了4种组织学类型胶质瘤的1893个差异表达蛋白。(E-F)通路富集分析。(G-H) 代谢相关网络分。(I-J) 4级胶质瘤的代谢神经和免疫相关蛋白热图。
02
胶质瘤的蛋白质组代谢神经和免疫亚型可以预测临床结果
在本研究的胶质瘤队列中,他们采用了基于蛋白质组数据进行亚型分类,因为与基因组数据相比,蛋白质组数据能更好地反映疾病状态和潜在生物学。他们首先筛选出 355 个在肿瘤和正常脑样本之间最显著差异表达的蛋白质。然后通过使用这些蛋白质进行无监督聚类,当 Silhouette 系数更接近 1 时,309 个肿瘤样本可分为两组,指定为亚组 1和亚组 2。在 355 种蛋白质中,共有 312 种蛋白质在亚组 1 和 2 之间显示出显著的差异表达。有趣的是,亚组 1 表现出代谢过程和神经递质受体活性的富集,包括谷氨酰胺酶 (GLS)、谷氨酸受体、GABA 受体和钙通道等蛋白质。因此,他们将这一组指定为代谢神经亚组,缩写为 S-Mn。相反,亚组 2 显示免疫和炎症蛋白的显著上调,包括 AKT2、CDK2、TGFB1 和 IRF3,他们将其命名为免疫亚组(缩写为 S-Im)(图 3A),该组亚型表现出不同的分子和临床特征。S-Mn 亚组中富集的蛋白质主要与突触形成信号通路和信号转导等通路有关。而 S-Im 亚组表现出主要参与 PD-1 癌症免疫治疗途径和死亡受体通路的蛋白质的富集。尤其是S-Mn组患者的临床疗效优于S-Im组(图 3B)。弥漫性胶质瘤蛋白质组的主成分分析有效地将两种亚型分层,第一个主成分将它们区分开来(图 3C)。
为了验证蛋白质组学分类的准确性,他们结合了 TCGA 基因表达数据进行分析,结果表明,亚型可以有效区分神经胶质瘤患者(图 3D),S-Mn 亚型患者预后良好,而 S-Im 亚型患者预后较差(图 3E)。热图显示了前 2000 种差异表达蛋白(图 3F),Kaplan-Meier 曲线显示 S-Mn和 S-Im亚型之间存在显著的预后差异(图 3G)。考虑到不同WHO分级和IDH状态患者的不同预后,他们还对数据进行了分层,并对1-3级、4级和IDH野生型患者进行了亚组聚类。所有患者的最佳分组都是通过将他们分为两类而实现的,其中S-Mn中的患者无论其WHO分级和IDH状态如何都表现出更好的临床生存率,这表明本研究蛋白质组学亚型聚类的稳定性和预测能力,两亚组分类适用于所有弥漫性胶质瘤。
大量研究揭示了IDH状态对神经胶质瘤代谢和表观遗传重编程的重要性。IDH状态的重要性在2016年WHO中枢神经系统肿瘤分类中得到正式认可,并确立为具有预后结果的生物标志物。他们对不同WHO等级的IDH突变型和IDH野生型神经胶质瘤进行了比较分析,结果 发现了 203种差异表达蛋白(图S7A)。火山图清楚地说明了IDH突变型和野生型神经胶质瘤之间的差异蛋白质表达谱(图 S7B)。其中,线粒体酶谷氨酸脱氢酶GLUD1和GLUD 2在IDH突变肿瘤中显著上调,高谷氨酸神经递质通量通过供应α-KG来为柠檬酸循环提供能量并支持脂质合成,使细胞对IDH突变的生长抑制作用具有抵抗力。此外,胶质瘤进展标志物如LGALS3、FABP5、MSN和TAGLN2在IDHmut组中显著下调。值得注意的是,代谢过程和细胞因子信号通路,如脂质代谢、脂肪酸转运、 DNA生物合成过程、IL-12信号通路和IL-6信号通路,是受到显著影响的通路之一(图S7C)。接下来,他们研究了不同阶段IDH突变肿瘤内的差异蛋白。先前的研究已经阐明了4级和2/3级星形细胞瘤之间巨大的预后差异。研究结果表明,与4级相比,2 / 3级星形细胞瘤中CDK2和IRF3的表达显著降低,这与既定的共识一致,即CDKN2A/B的缺失伴随着CDK活性的增加,与胶质瘤的恶性进展密切相关(图 S7D)。最后,染色体复制途径的细胞周期控制是主要的差异通路,表明2/3级和4级星形细胞瘤之间的不同增殖特征(图 S7E)。

图3. 胶质瘤的蛋白质组代谢神经和免疫亚型可以预测临床结果。
(A) 热图显示了研究队列中的两种蛋白质组学亚型,基于肿瘤和正常脑样本之间 355 种差异表达蛋白质。(B) Kaplan-Meier 生存曲线。(C) 神经胶质瘤蛋白质组的PCA分析有效地将这两个亚型分层。(D) TCGA 基因表达数据的热图验证了两亚型蛋白质组学分类。(E) 基于 TCGA 数据的 95% CI 的 Kaplan–Meier 生存曲线显示 S-Mn 亚型的 OS 较好,S-Im 亚型的 OS 较差。(F) NC 2022 的蛋白质组学数据热图显示了前 2000 种差异表达蛋白质。(G) 基于NC 2022 数据的 95% CI 的 Kaplan–Meier 曲线显示 S-Mn 组的预后优于 S-Im 组。
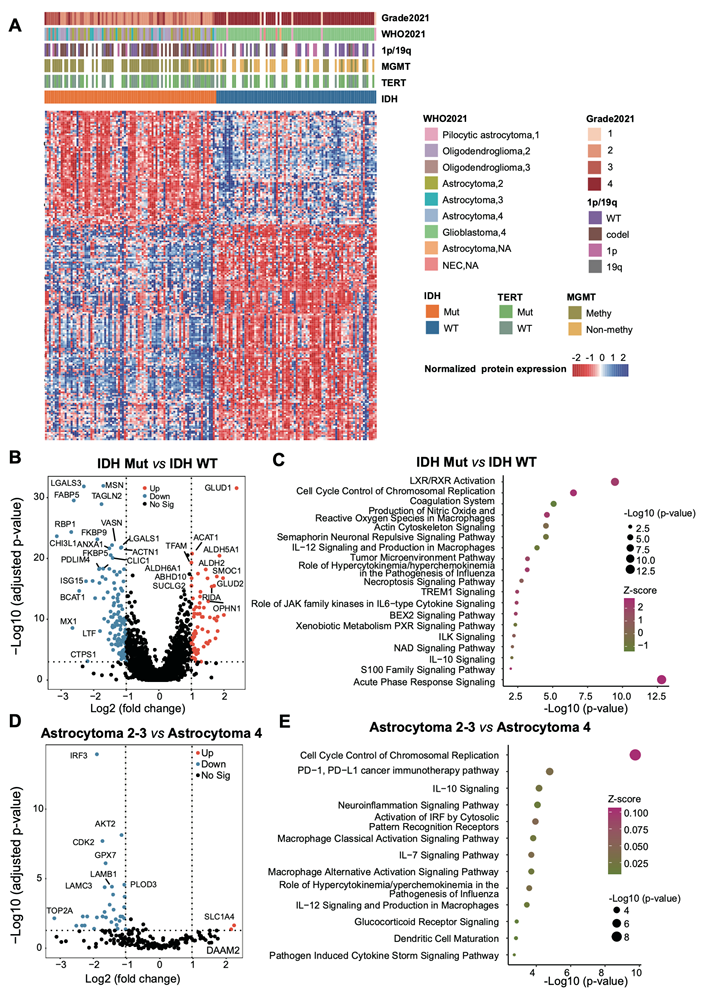
图S7. 胶质瘤的IDH状态影响免疫和代谢蛋白质组分析。
(A) 热图显示IDH突变型与野生型胶质瘤中203个差异表达蛋白。(B) 火山图显示了203个差异表达的蛋白质。(C)通路富集分析。(D) 火山图显示了34个在2-3级和4级星形细胞瘤之间差异表达的蛋白质。(E) 通路富集分析。
03
嘧啶代谢与胶质瘤患者的生存有关
代谢重编程是癌症的一个标志,代表了神经胶质瘤发生的早期事件。例如,GBM 细胞通过上调与嘧啶代谢相关的酶来适应其独特的微环境,促进快速细胞增殖和 DNA 损伤修复。为了缩小与生存更相关的蛋白质的范围,他们选择了 89 名长期生存期(≥30 个月,N = 48)和短期生存期(≤12 个月,N = 41)的患者。不同级别 和 IDH 野生型神经胶质瘤的总体生存率分布如补充图 S8A所示。他们最初的筛选过程重点是识别与肿瘤代谢相关的肿瘤和正常外观脑样本之间的差异表达蛋白(图3A)。随后,他们进行了进一步筛选,以确定在该 89 名患者队列中也显示出与预后显著相关的代谢蛋白(14 种代谢蛋白和 11 条代谢通路)。同时,他们选择了四组中差异表达蛋白质,并且与代谢相关。这两个筛选阶段的交集导致鉴定出 11 条通路,包括 25 种蛋白质。他们发现 18 种蛋白质既与代谢相关又有预后意义(图 4A)。所有这 18 种蛋白质的表达水平都与患者的预后密切相关。他们继续根据这些蛋白质的表达建立风险评分模型,Kaplan-Meier 曲线证实低风险评分组的患者表现出更有利的临床结果(图 4B)。进一步分析这些代谢通路,他们发现它们主要参与嘧啶代谢,而嘧啶代谢与DNA和RNA合成密切相关(图 4C)。为了验证该模型的稳健性,他们分析了TCGA数据,结果与本研究数据一致(图 4D)。因此,该分析进一步证实了核苷酸代谢在控制胶质瘤细胞行为和患者生存中的关键作用,而代谢重编程特别是核苷酸代谢如何导致肿瘤恶性程度还有待探索。
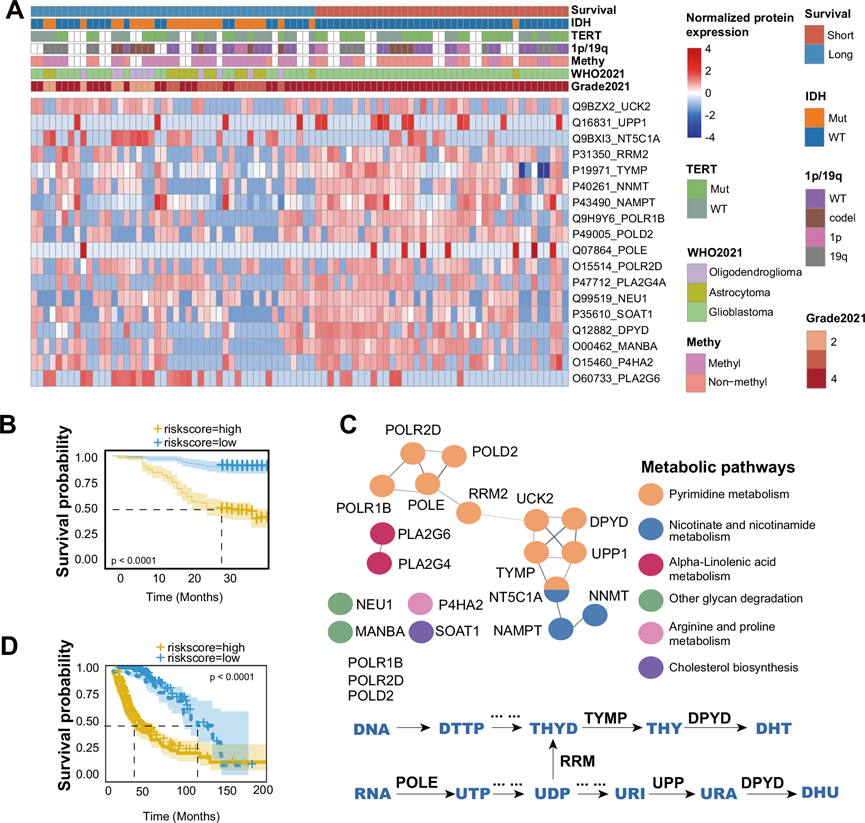
图4. 嘧啶代谢与胶质瘤患者的生存相关。
(A) 热图显示长期生存期和短期生存期组之间 18 种不同的表达蛋白。(B) Kaplan -Meier 生存曲线。(C) 通路富集分析表明嘧啶代谢主要参与其中。(D) 用TCGA数据的 95% CI Kaplan-Meier 生存曲线验证 了风险评分模型。
04
DPYD 和 TYMP 是 GSC 增殖和自我更新所必需的
他们发现分解代谢酶在此过程中发挥着重要作用,核苷酸代谢的稳态需要核苷酸生物合成和降解之间的平衡,影响核苷酸池的平衡可能导致基因组不稳定性和癌症进展。其中,二氢嘧啶脱氢酶 (DPYD)和胸苷磷酸化酶 (TYMP) 是调节嘧啶核苷分解代谢的酶。为了探索它们在神经胶质瘤中的潜在功能和机制,重点研究了它们在患者来源的神经胶质瘤干细胞(GSC)中的作用,GSC 位于胶质母细胞瘤细胞层次的顶端,具有自我更新作用,导致治疗耐药性和肿瘤复发。
最初,根据蛋白质组学分析得出的 DPYD 和 TYMP 表达水平将患者分为高表达组和低表达组。为了验证蛋白质组学分析结果的准确性,他们对每组中随机选择的七个患者样本进行了免疫组织化学 (IHC) 分析,从 IHC 获得的数据与蛋白质组学分析一致(图 5A)。随后,他们使用两个独立的 shRNA 有效降低 T4121 和 Mes28 细胞中的 DPYD 和 TYMP mRNA 水平,并通过实时 PCR 证实(图5B)。
敲低 GSC 中的 DPYD 和 TYMP 会显著损害其增殖能力,敲低后第 3 天和第 5 天细胞数量减少就是明证(图 5C)。此外,通过体外有限稀释试验(图 5D)和神经球形成实验进行评估(图 5E),GSC 的自我更新能力也受到损害。具体而言,DPYD 和 TYMP 敲低的 GSC 中球体的数量和大小显著减少(图 5G)。
鉴于这两种蛋白质与 DNA 代谢的密切联系,以及众所周知的 GSC 的 DNA 损伤修复能力,这会导致治疗耐药性(化疗药物和放疗),他们通过免疫印迹和免疫荧光实验评估了 GSC 中磷酸化 γH2A.X 的水平。DPYD 的敲低导致严重的 DNA 损伤和细胞凋亡,如细胞核内磷酸化 γH2A.X 病灶增加(图 5F-I)以及磷酸化 γH2A.X 和裂解 caspase-3 (CC3) 的蛋白质水平升高(图 5I)。总之,这些发现证明 DPYD 和 TYMP 在 GSC 维护和 DNA 代谢中的关键作用。
为了探究 DPYD 和 TYMP 在体内治疗靶向性的潜在益处,他们给患有颅内患者来源的 GSC 肿瘤的小鼠转导了非靶向性对照 shRNA (shCont) 或靶向 DPYD 和 TYMP 的 shRNA。DPYD 和 TYMP 的敲低显著延长了小鼠的存活期(图 5J)。随后,处死小鼠,对其大脑进行苏木精和伊红 (H&E) 染色以评估神经胶质瘤的存在,证实在缺乏 DPYD 和 TYMP 的 GSC 中没有神经胶质瘤生长(图 5J)。此外,对 43 例胶质母细胞瘤 (GBM) 患者的病理切片进行免疫组织化学分析显示,DPYD 和 TYMP 的高表达水平与预后不良相关(图 5K)。总之,这些发现揭示了 DPYD 和 TYMP 在体内胶质瘤发生和生长中的重要性,从而强调了以核苷酸代谢为靶点作为治疗胶质瘤的潜在策略的重要性。
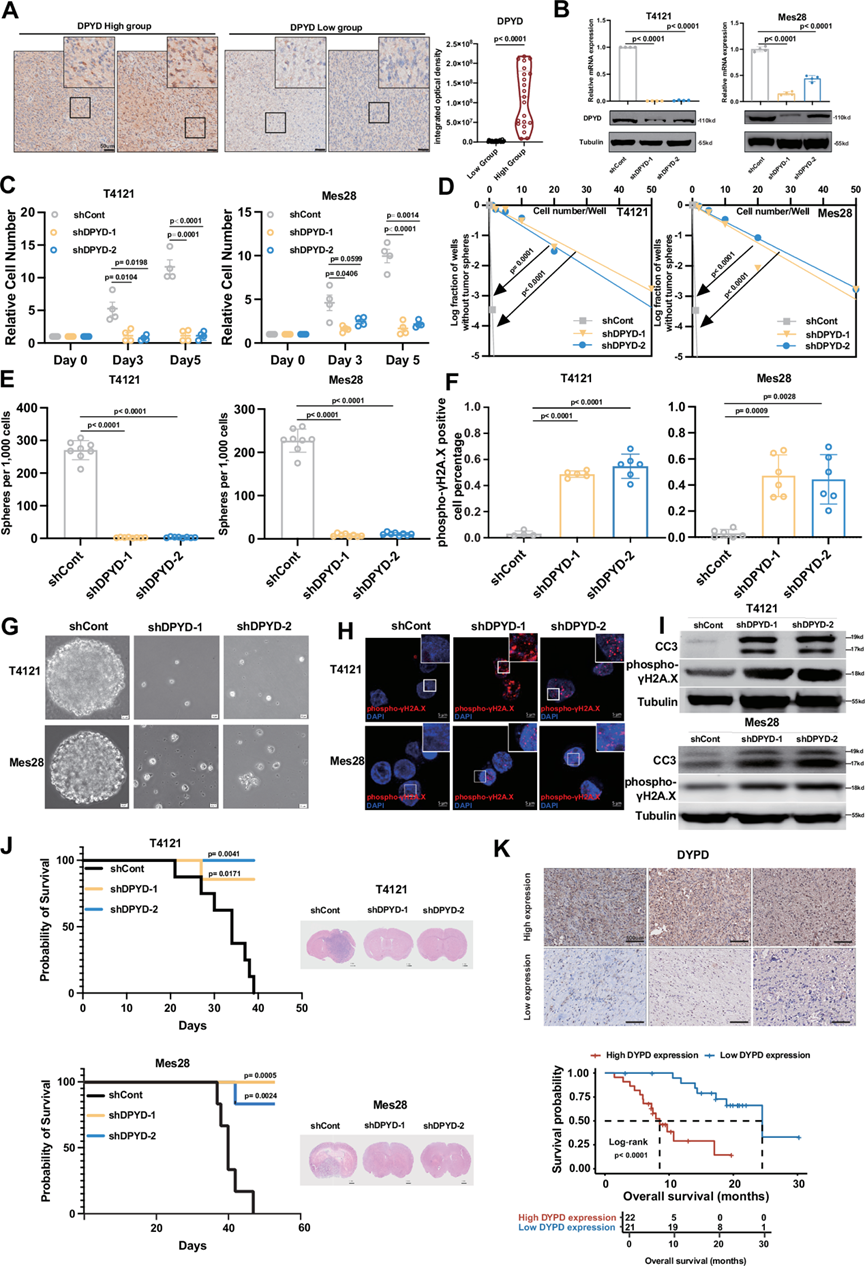
图5. DPYD 是 GSC 增殖和自我更新所必需的。
(A) 基于蛋白质组学分析的二氢嘧啶脱氢酶 (DPYD) 表达的IHC验证。(B) 敲低后T4121和Mes28细胞中的DPYD mRNA水平和蛋白质水平显示出大于50%的效率。(C) 增殖试验表明,靶向 DPYD 会损害增殖,通过第 3 天的细胞数量进行评估。(D) 体外极限稀释试验。(E,G) 肿瘤球形成揭示了DPYD敲低GSC的自我更新受损。(F,H) 免疫荧光显示 DPYD 敲低后,GSC 细胞核中磷酸化 γH2A.X 病灶增多,表明 DNA 损伤严重。(I)免疫印迹分析。(J) 敲低 DPYD 可显著提高小鼠存活率。(K) 对另一组胶质瘤患者的外部验证证实了 IHC 的差异表达,Kaplan-Meier 生存曲线显示高 DYPD 表达组的预后不良。
+ + + + + + + + + + +
结 论
本研究使用来自 188 名患者的 343 个福尔马林固定和石蜡包埋的肿瘤样本和 53 个正常脑样本对神经胶质瘤进行蛋白质组学分析,并将这些数据与基因组面板信息和临床结果相结合。蛋白质组学分析发现了两个不同的亚群:亚群 1,代谢神经亚群,富含代谢酶和神经递质受体蛋白;亚群 2,免疫亚群,以免疫和炎症蛋白上调为标志。这些蛋白质组学亚群在预后、肿瘤发生、微环境失调和潜在治疗方法方面表现出显著差异,突出了代谢和免疫过程在神经胶质瘤生物学和患者结果中的关键作用。二氢嘧啶脱氢酶 (DPYD) 和胸苷磷酸化酶 (TYMP) 成为与核苷酸代谢重编程相关的潜在预后生物标志物。患者来源的胶质瘤干细胞和动物模型中的功能验证突出了核苷酸代谢是胶质瘤有希望的治疗靶点。这项综合多组学分析引入了胶质瘤的蛋白质组学分类,并确定了 DPYD 和 TYMP 是关键的代谢生物标志物,为胶质瘤的发病机制和潜在治疗策略提供了见解。
+ + + + +



 English
English


