文献解读 |Science ( 45.8 ):异常基底细胞克隆动力学决定早期肺癌的发生
✦ +
+
论文ID
原名:Aberrant basal cell clonal dynamics shape early lung carcinogenesis
译名:异常基底细胞克隆动力学决定早期肺癌的发生
期刊:Science
影响因子:45.8
发表时间:2025.06.12
DOI号:10.1126/science.ads9145
背 景
肺鳞状细胞癌 (LUSC) 是由癌变区域演变而来的,癌变区域是一群可能没有形态变化的细胞,但却呈现出一些与肿瘤发生有关的表型改变,并携带癌症相关的分子异常。后者与衰老等内在过程和接触香烟烟雾中的诱变剂等外在因素有关。随着损伤的持续,支气管上皮中会出现越来越紊乱的癌前病变,其中一半最终会发展为 LUSC。阐明组织学正常的气道转变为癌前疾病的生物学机制将有助于设计早期癌症拦截策略。
实验设计
结 果
01
NTCU引起的鳞状肺病变源自预先存在的基底细胞
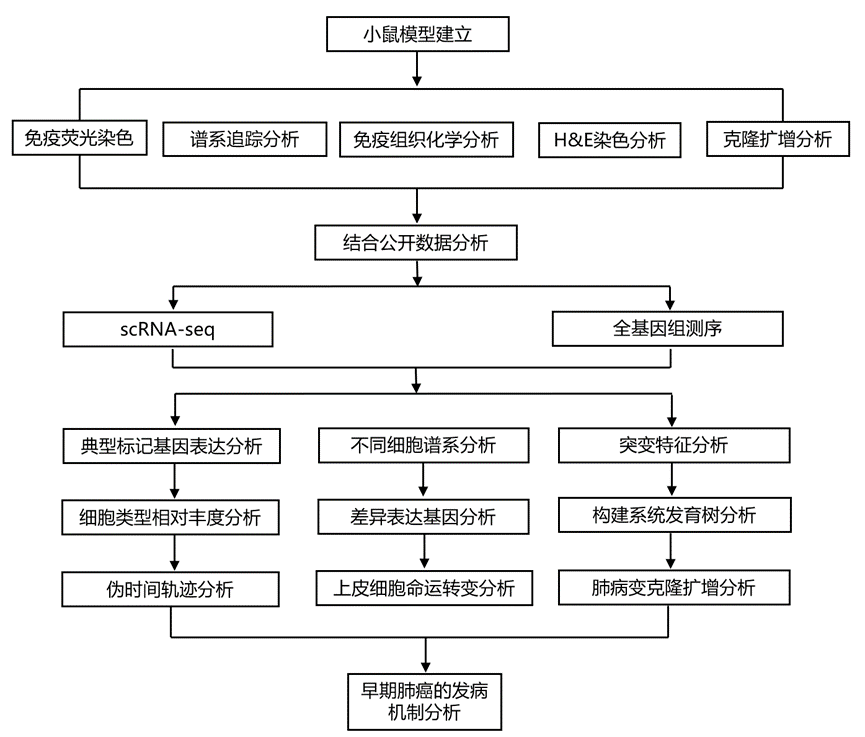
N-亚硝基三氯乙基脲 (NTCU) 是一种 DNA 烷化剂,它能诱导小鼠发生癌前鳞状细胞肺病变和侵袭性 LUSC,从而可以从最早阶段检查鳞状细胞肺致癌作用。研究团队给小鼠局部注射NTCU 12周,首先导致沿支气管树形成侵袭性肺病变,并最终在接下来的12周内发展为侵袭性肺鳞状细胞癌(图1A-C)。该小鼠模型的组织学和进展性质与人类LUSC非常相似,使其成为追踪该疾病细胞起源的理想模型。
为了评估基底细胞在NTCU诱导的体内致癌作用中的贡献,他们使用了谱系追踪技术。与人类呼吸道不同,基底细胞遍布于整个传导气道,包括细支气管,而在小鼠中,它们主要局限于肺外气道。Tg (KRT5-CreER);R26R-tdTomato小鼠(以下简称KRT5-CreER;tdTomato)连续五天接受他莫昔芬治疗,以高密度标记气道基底细胞(图1D)。他们在最后一次服用他莫昔芬四天后通过全细胞免疫染色证实了tdTomato在绝大多数KRT5+气管基底细胞中的表达(图1E)。然后用 NTCU 治疗小鼠 12 周,并在使用他莫昔芬 18-24 周后在组织全支架中检查气管支气管树(图1F-G)。在仅用他莫昔芬治疗的对照小鼠中,tdTomato+细胞在整个 24 周内仍然局限于主支气管的近端,与上皮的区室化一致(图 1F)。然而,在 NTCU 治疗组中,在主支气管和细支气管中可以明显看到共表达 tdTomato 和 KRT5 的细胞(图1G)。对 tdTomato+ KRT5 +支气管上皮切片的组织学分析证实了存在癌前病变,从扁平异形性到鳞状上皮发育不良(图 1H-I)。在8个不同个体中发现的所有病变均为tdTomato阳性。这些发现表明,NTCU诱导的鳞状肺病变源自谱系标记的基底细胞。值得注意的是,对表达Scgb1a1的分泌细胞进行谱系追踪,发现该细胞群对NTCU诱导的疾病没有贡献。
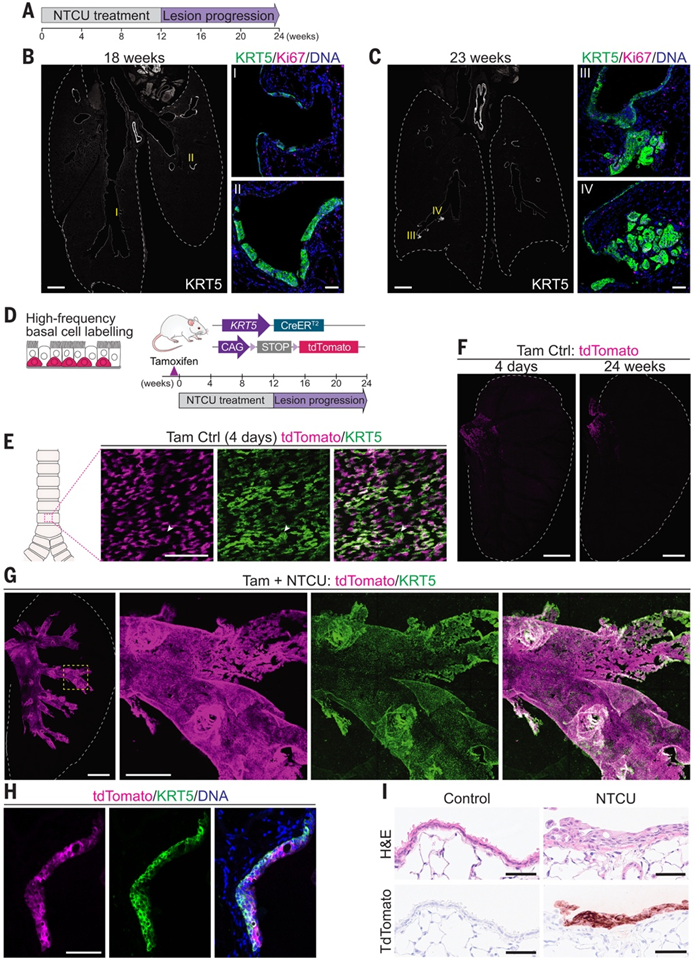
图1. NTCU 诱发的鳞状肺病变由预先存在的基底细胞发展而来。
(A) NTCU 诱导小鼠 LUSC 的给药方案。(B-C) 免疫荧光分析。(D) 实验设计。(E-H) 免疫荧光分析。(I) (上)用 H&E 染色,(下)免疫组织化学分析。
02
NTCU诱导非中性突变克隆扩增
为了阐明致癌物暴露如何改变气道基底细胞行为,他们使用了镶嵌细胞标记技术。KRT5 -CreER;tdTomato小鼠在接受 12 周 NTCU 治疗前 4 天给予一剂他莫昔芬(图 2A)。对照组动物仅接受他莫昔芬治疗。在给予他莫昔芬 24 周后,对气管背侧和腹侧半部进行整体检查(图 2B)。在对照组中,tdTomato 标记的基底细胞大多沿气管近远端轴线产生离散的克隆。散在的单细胞也很明显(图 2C)。相反,NTCU 治疗导致形成大的 tdTomato+斑块,这些斑块相互融合。在两组中,背侧气管中的克隆边界通常遵循纵向平滑肌带。然而,腹侧软骨上的克隆具有更弥散的边缘,在 NTCU 治疗后形成了不那么碎片化的模式。
他们随后应用生物物理模型研究对照组和NTCU处理组的基底细胞克隆动力学,聚焦于气管上皮(范围至气管分叉前)。在稳态过程中,基底细胞通过随机自我更新维持平衡——细胞复制与基底细胞层的分化和丢失速率完全匹配。为模拟这一动态,他们采用基于中性"投票者模型"的最小化建模方案:将基底细胞层表示为晶格结构,其中随机分化丢失通过邻近基底细胞复制补偿(图2D)。为模拟KRT5-CreER;tdTomato气管的嵌合标记,晶格模型中的细胞初始空间分布与4天标记对照组一致。通过比较细胞聚类(称为"空隙")的实际分布,发现对照组气管背腹侧空隙尺寸累积分布呈现幂律依赖特征(指数约-1),符合基底细胞中性竞争维持组织稳态的预期,且与标记后24周的实验数据高度吻合(图2F)。与中性模型特征幂律行为的微小偏差可能源于组织标记的不均匀性。相比之下,NTCU处理组的分布发生偏移,大尺寸空隙比例增加,背离了中性模型的典型幂律特征(图2G)。虽然NTCU可能影响全体基底细胞,但数值模拟表明全局增殖加速或标记比例/分布的改变均不足以解释空隙尺寸分布的变化。EdU标记分析进一步证实,两组单位面积内周期细胞数量无统计学显著差异(图2C)。
他们提出假说:NTCU处理通过改变部分基底细胞的命运并损害其分化能力,从而引入系统异质性。为验证此假说,他们构建了一种动力学模型,其中少量高适应性突变基底细胞通过对称分裂取代邻近的类正常突变细胞(图2D)。这导致非中性竞争——高适应性突变克隆以消耗类正常细胞为代价扩张领域。在该模型中,高适应性突变克隆与类正常克隆发生非中性竞争,但彼此间保持中性竞争。数值模拟显示,当少量高适应性突变克隆随机分布于系统时,模型成功重现了大型标记与非标记区域斑块,与实验数据高度吻合(图2G)。
图2. 致癌物暴露诱发非中性基底细胞克隆扩增。
(A)实验设计。(B) 对照组和 NTCU 治疗组小鼠在服用他莫昔芬后 4 天和 24 周的背气管整体的 3D 投影。框中区域表示背部平滑肌,纵向延伸在开放的软骨环之间,其背端可以在制剂的侧边缘看到。(C) (B) 中虚线框所示区域中的背气管上皮图像。对 24 周样本进行 EdU 染色。(D) 描述对照组(上)和 NTCU 治疗组(下)气管中基底细胞层动态的生物物理模型示意图。(E) 服用他莫昔芬 4 天后,在对照气管中观察到大于给定大小的空隙的累积概率。(F) 服用他莫昔芬 24 周后,在对照气管中观察到大于给定大小的空隙的累积概率。(G) NTCU 治疗小鼠在服用他莫昔芬 24 周后,气管中观察到大于给定尺寸空隙的累积概率。
03
致癌物暴露导致气道上皮细胞基底细胞命运转变
为了研究 NTCU 暴露对假复层气道上皮不同细胞类型的影响,并深入了解基底细胞动态变化的潜在机制,他们进行了单细胞转录组分析(scRNA-seq)。在治疗完成 3 周后(治疗开始后 15 周),从接受 NTCU 治疗的小鼠中分离气管细胞。未治疗的年龄匹配小鼠的细胞用作对照(图 3A)。在 6 只小鼠中,共保留了 30020 个细胞进行质量控制后的分析。基于典型标记基因的表达,他们概括了所有聚类的总体细胞身份,将它们分为上皮细胞(Epcam、Krt5、Trp63)、巨噬细胞(Il1b、Mpeg1、Cd68)和 T 细胞(Itk、Cd3e、Cd3d)。
接下来,他们将上皮细胞部分(29088 个细胞)与免疫细胞区室分开进行亚聚类(图 3B)。从小鼠气道单细胞研究中收集细胞类型参考特征,并用于识别单个上皮细胞类型(图 3B-C)。他们证实了先前描述的上呼吸道细胞类型的存在,包括基底细胞、Krt4/Krt13+、棒状/分泌细胞、纤毛细胞、神经内分泌细胞和丛状细胞以及离子细胞。根据先前报道的小鼠基底细胞区内的异质性,他们鉴定了五个基底细胞聚类(图3B-C)。这些细胞亚群包括“基底增殖”细胞亚群(Mki67、Stmn1、Birc5和Top2a),以及以高Tgm2、Dcn和Dlk2表达为特征的细胞部分,标记为“基底 Tgm2+”。根据Krt14表达水平,可将两个亚群与其余基底细胞区分开来;“基底”部分表现出可忽略不计的Krt14水平,而“基底 Krt14 +”聚类显示出高Krt14表达。最后,第五个较小的基底细胞亚群显示出高水平的Trp63和Mecom。
为了确定 NTCU 可能引起的气管上皮细胞组成的变化,他们使用 scCODA ( 24 ) 进行了差异丰度分析。NTCU 暴露导致基底细胞池发生变化,缺乏Krt14表达的基底细胞显著减少,同时Krt14+基底细胞增加(图3D-E)。这种变化伴随着NTCU 治疗后Krt4/Krt13+细胞分数的扩大。气管上皮的免疫染色分析证实了 KRT14 的上调,KRT13 +细胞在基底和基底上位置的积累,并揭示了 NTCU 治疗开始 15 周后 SCGB1A1 +分泌细胞大量减少。
Krt14在损伤后气道上皮中上调,但其持续表达与修复失调和侵袭前疾病有关,包括 NTCU 诱导的气管发育不良,据报道,在该模型中,气管发育不良先于支气管发育不良发生。为了深入了解导致观察到的细胞组成变化的上皮细胞动态,他们使用 Monocle方法进行轨迹分析,重点关注基底细胞聚类、Krt4/Krt13+细胞聚类和分泌细胞聚类。该分析根据细胞的相对基因表达对细胞进行排序,假设细胞沿着发育轨迹处于不同的状态。伪时间分析揭示了一个生物学上合理的进程:从以增殖细胞和Krt14+基底细胞(细胞状态 1)为主的状态开始,过渡到Krt4/Krt13 +细胞和分泌细胞(细胞状态 2)或基底细胞(细胞状态 3)(图 3F)。这一轨迹与已知的基底细胞分裂导致分化或自我更新的结果相一致,也符合Krt4/Krt13+细胞构成从基底分化到分泌分化的可能路径之一的过渡状态的观点。对轨迹每个分支上的细胞类型分布和丰度进行可视化后发现,与对照组相比,NTCU 治疗组首先在路径开始时Krt14+基底细胞富集,其次在“分化”分支上Krt4/Krt13 +细胞积累,分泌细胞较少(图 3G)。对 NTCU 治疗完成 6 周后获得的组织进行全装填分析表明,与年龄匹配的对照组相比,气管上皮中的 KRT13 表达显著增加,SCGB1A1 免疫反应性降低(图3H-I)。由于 SCGB1A1+分泌细胞作为纤毛细胞的祖细胞,他们评估了该群体的变化。NTCU 治疗后,纤毛细胞标记物 FOXJ1 的表达显著降低。
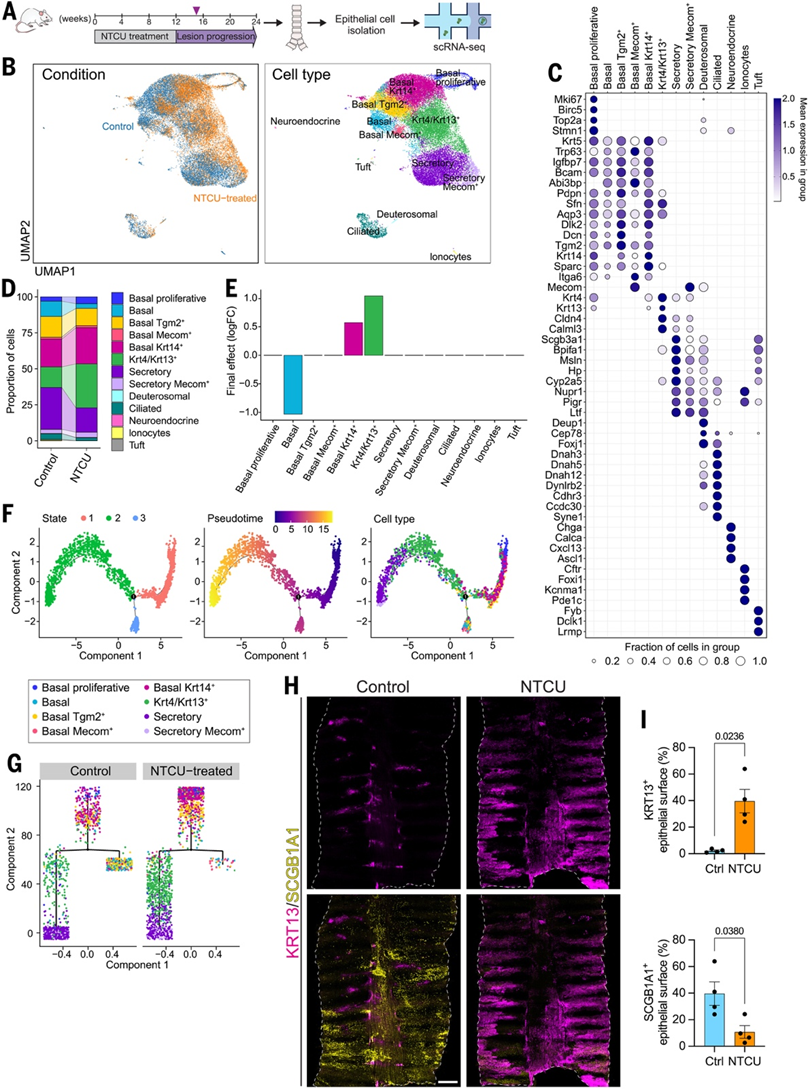
图3. 单细胞分析揭示NTCU治疗后上皮细胞命运发生转变。
(A) NTCU 治疗组和年龄匹配的对照小鼠的气管上皮单细胞转录组 (scRNA-seq) 分析实验概览。(B) UMAP 可视化图。(C) 点图描绘了 (B) 中所示细胞类型的选定标记基因的表达情况。(D) 条形图显示治疗开始 15 周后,NTCU 治疗组和对照组中气管上皮细胞类型相对丰度的变化。(E) 条形图显示使用 scCODA 计算的 NTCU 治疗组和对照小鼠之间每种细胞类型丰度变化。(F) 伪时间进展分析。(G) 可视化对照组和 NTCU 治疗组中树状结构每个分支上细胞类型的分布和相对丰度。(H) 免疫荧光检测。(I) NTCU 治疗开始 18 周后,对对照组和 NTCU 治疗组小鼠中表达(上) KRT13 和(下)分泌标志物 SCGB1A1 的气管上皮表面进行定量分析。
04
人类早期鳞状细胞肺癌发生过程中上皮细胞命运的转变
接下来,他们探讨了致癌物暴露对组织学正常的人类气道上皮的影响,从3名从不吸烟者和3名目前吸烟者身上获取气管刷,并使用scRNA-seq进行分析。该数据集与另外两个队列的公开气管活检数据整合,其中一个队列包含6名从不吸烟者和6名目前吸烟者(29),另一个队列包含9名健康的非吸烟者。共计45959个上皮细胞用于下游分析。使用先前描述过的特征对细胞类型进行注释,从而鉴定出基底细胞、基底上层细胞、分泌细胞、浆液细胞、氘体细胞、纤毛细胞、神经内分泌细胞以及离子细胞(图4A-B)。在基底细胞和基底上层细胞群中检测到了不同程度的异质性(图4A-B),他们还鉴定出了一个KRT4/KRT13+细胞亚群(图4A-B)。
为了全面评估香烟暴露的影响,他们使用 MiloR 进行了差异细胞丰度分析。这表明吸烟者体内KRT4/KRT13+细胞富集(图 4C-D)。为了阐明KRT4/KRT13 +细胞状态与人类气道表面上皮中基底、超基底和分泌群体之间的关系,他们使用 Slingshot 推断谱系轨迹。以循环基底细胞聚类为起点,鉴定出三种不同的细胞谱系(图 4E)。谱系 1 对应于自我更新的基底细胞。谱系 2 和谱系 3 都经历了KRT4/KRT13状态的转变。然而,谱系 2 遵循分泌细胞分化的路径,而谱系 3 则经历了不同的超基底细胞状态(图 4E)。整个谱系的伪时间分布分析表明,与非吸烟者相比,吸烟者沿谱系 2 和 3 的进展较慢,到达轨迹中点的细胞密度较高,而到达路径末端的细胞较少(图 4F)。为了评估吸烟状况对细胞命运选择的差异,他们比较了平均谱系权重,它代表每个细胞对特定谱系的相对贡献。这表明吸烟者从谱系 3 转向谱系 2(图4G),这是由于吸烟者上皮中KRT4/KRT13 +细胞比例增加,同时基底上层细胞减少。因此,在小鼠和人类中,致癌物暴露会导致不同的细胞命运选择和气道上皮中处于过渡KRT4/KRT13 +状态的细胞积聚。
然后,他们根据 scRNA-seq 分析中发现的前 50 个差异表达基因,获得了KRT4/KRT13基因表达特征,并评估了其在大量 RNA-seq 数据集中的表达,该数据集包括来自 77 名患者的 122 份人类支气管活检样本,涵盖从组织学正常的气道到各个侵袭前疾病阶段直至 LUSC。他们发现与正常组织相比,从化生到原位癌 (CIS) 的侵袭前病变以及侵袭性肿瘤中KRT4/KRT13特征显著富集(图 4H)。这支持了该细胞状态与侵入前疾病发展的相关性
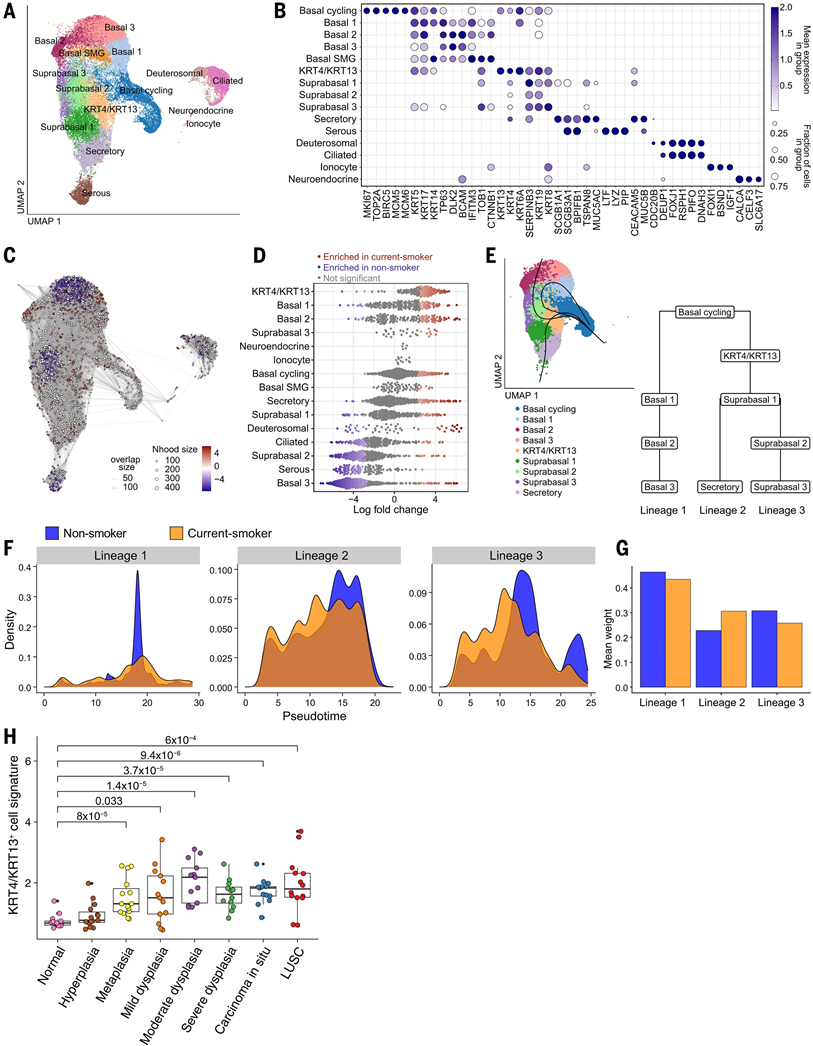
图4. 人类肺鳞状细胞癌变早期过程中的上皮细胞移位。
(A) UMAP 对人类气管上皮细胞的可视化。(B) 点图显示已鉴定的人类气管上皮细胞群的选定标记物的表达。(C) 邻域图显示使用 MiloR 进行差异细胞丰度测试的结果。(D) 蜂群图显示非吸烟者和当前吸烟者之间气管上皮细胞丰度的差异倍数。(E) 使用 Slingshot 生成的表面气道上皮的基底、超基底和分泌细胞群的细胞谱系分析。(F) 在表面气道上皮中鉴定的三个细胞谱系的伪时间分布,显示了非吸烟者和当前吸烟者之间的差异。(G) 描绘平均谱系权重的图。权重分配表示每个细胞属于特定谱系的概率。(H) 正常气道上皮中的KRT4 / KRT13特征评分,增加了肺癌前鳞状细胞病变和 LUSC 的等级。
05
NTCU 对呼吸道上皮细胞的致突变作用
NTCU 属于亚硝脲类化合物,是常用于化疗的 DNA 烷化剂,类似于顺铂或卡铂等铂类化疗药物或替莫唑胺等非经典烷化剂。研究表明,烷化剂可在 DNA 上诱导细胞毒性和致突变加合物,留下诱变剂特异性的 DNA 损伤特征。他们利用激光捕获显微切割 (LCM) 技术,随后进行全基因组测序 (WGS),分析了 NTCU 对整个支气管树上皮细胞的基因组影响。在 NTCU 开始治疗后 23 周和 24 周,分别从两只小鼠 MD6812 和 MD7047 身上获取了共 142 个气管和肺内气道上皮微活检样本。气管的中位微活检体积略高于肺上皮的中位微活检体积(图S7A)。
最初,他们使用 WGS 数据,通过定制的计算工作流程研究两只小鼠的单碱基对替换 (SBS) 以及插入/缺失负担。单个微活检样本可能包含来自多个克隆群体的细胞,表现为在相似变异等位基因分数 (VAF) 处发现的突变聚类。考虑到体细胞突变的杂合性,所有来自最近共同祖先的细胞的完全克隆微活检的 VAF 分布将以 0.5 为中心。因此,采样克隆数量的增加将导致该中心向较低的 VAF 移动。鉴于检测到的突变数量众多且为了便于比较,他们根据微活检样本在左肺或右肺的位置对其进行了分离。这使他们能够比较不同解剖区域内每个克隆的 SBS 和插入/缺失负担(图 5A;图 S7)(40)。由于检测分配给克隆的体细胞突变的能力高度依赖于底层微活检的测序深度,他们进行了逻辑回归,以根据其预测的灵敏度调整每个克隆的负担(图 S7B)。结果表明单核苷酸变异(SNV)负担存在相当大的差异,MD6812 和 MD7047 的平均单碱基替换分别为 6022 和 16345 个。相反,两只小鼠的双碱基替换和插入/缺失的平均负担相当。
他们使用分配给每个克隆的底层替换来执行突变特征分析。通过贝叶斯分层狄利克雷过程提取每个克隆的突变特征,评估它们与 COSMIC 中定制参考特征的相似性(图 5A,图 S7D-E)。他们发现与时钟样过程相关的普遍突变特征随年龄线性累积,最重要的是 SBS5(图 5A)。包括 SBS11、SBS32 和 SBS36 在内的众所周知的化疗特征在本研究的数据集中也很常见。然而,数据集中最主要的特征未在 COSMIC(v3.2)中列出。该特征的特点是 ATN 位点的 T>A 和 T>G 替换(图 5B),与之前描述的烷化剂特征共有特征,因此与 NTCU 治疗直接相关。他们使用 SigProfiler 作为独立方法来验证此 NTCU 特征(图 S7E)。该标记在气管和肺的克隆中均有存在,占全基因组数据中所有突变的36%,以及单个克隆中高达85%的突变(图5A)。总体而言,在整个数据集中,双碱基替换和插入/缺失突变谱均未显示出高于预期的改变负荷,且无明显的NTCU相关致突变效应(图S7C)。
最后,他们使用鸽巢原理推断了所有微活检中克隆之间的系统发育关系,总共得到了 4 棵系统发育树,每棵树的顶端代表一个克隆(图 5C)。他们经常观察到更大的进化枝,其中单个克隆来自共同的祖先(图 5C)。在大型克隆扩增的创始突变中,他们观察到了已知在人类 LUSC 中突变的基因的可能功能性突变。总之,NTCU 处理的气道的基因组图谱显示出诱变剂暴露的印记,以独特的突变特征突出显示。该数据集中的克隆偶尔显示出高度的系统发育关系,其中高度突变的共同祖先产生了几个后代。
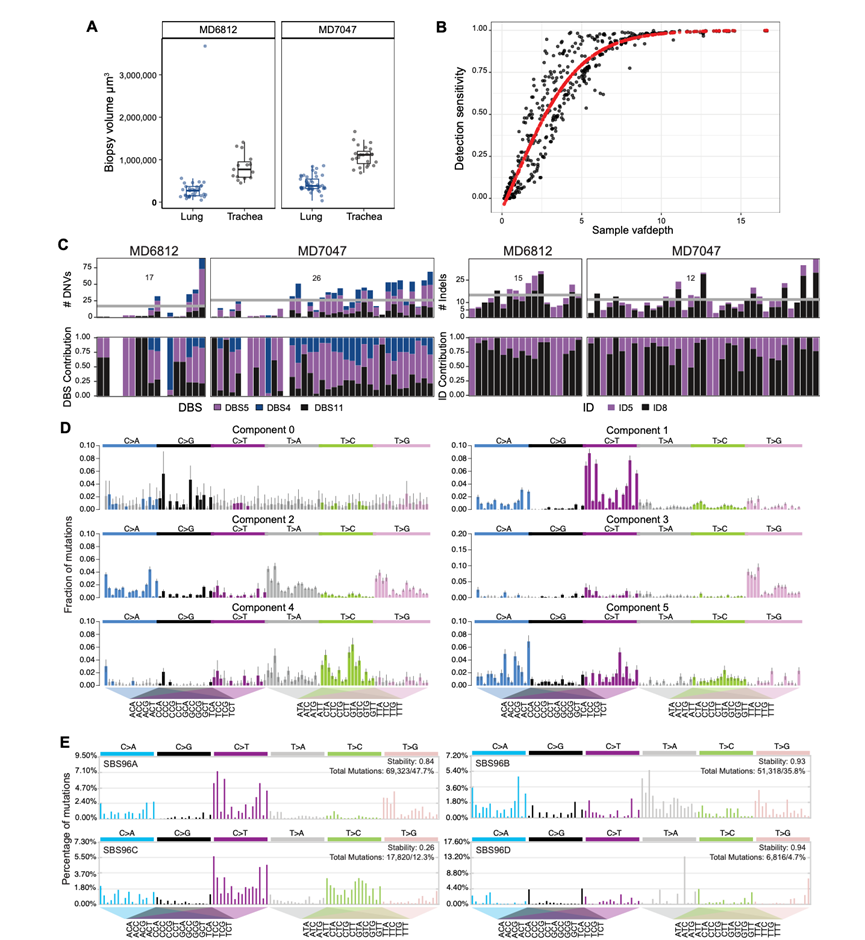
图S7. 小鼠气道上皮的基因组改变和特征。
(A) 两只小鼠的解剖活检体积,根据解剖位置进行分割。(B) 显示SNV检测灵敏度(y轴)作为每个克隆的变异等位基因比例的函数与每个样本的测序覆盖率(x轴)之间关系的Dotplot。(C) 在两个ntcu处理的小鼠中检测到不同克隆的二核苷酸核苷酸变异(DNV)和插入和缺失(indel)以及相应的突变过程(DBS)负荷。(D) 使用HDP从突变特征分析中提取成分。(E) 使用sigProfiler从突变特征分析中提取数据。
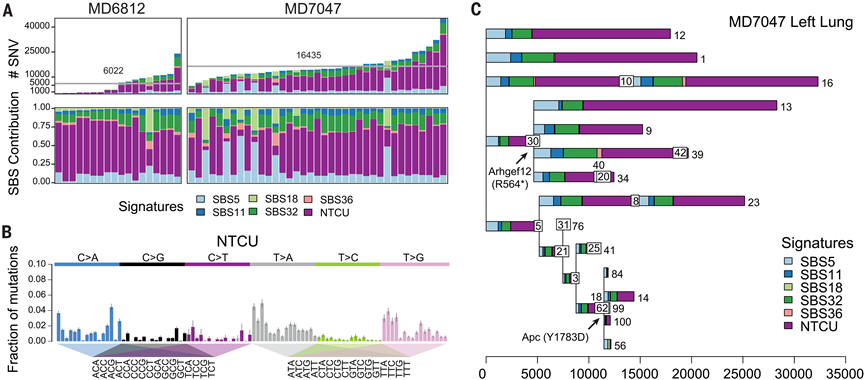
图5. NTCU对呼吸道基底细胞的致突变作用。
(A) 在接受 NTCU 治疗的两个小鼠中检测到的克隆中的 SNV 和 SBS 标记负担。(B) NTCU 标记的三核苷酸背景谱。(C) 位于小鼠 MD7047 左肺的样本和克隆的系统发育树。
06
非中性基底细胞竞争推动呼吸道内细菌的逐渐定植和克隆扩增
接下来,他们结合免疫荧光成像、生物物理建模以及基因组和组织学信息,评估了 NTCU 致突变性对整个肺内气道克隆动态的影响。除了小鼠上呼吸道假复层上皮中的基底细胞池之外,在远端肺中还可以发现在流感引起的气道损伤后扩增的稀有小聚类 p63 + KRT5 +细胞。为了确定导致早期肺癌病变形成的基底细胞群,他们分析了从 NTCU 治疗开始的不同时间点肺全组织中 KRT5 的表达(图 6A)。在接触致癌物后,KRT5+细胞逐渐以从近端到远端的方式占据肺内气道,形成一个前进的前沿。未观察到明显离散的细支气管周围 KRT5 +细胞聚类。这表明鳞状肺病变是由近端气道基底细胞发展而来的,这些细胞超出了其微环境,并逐渐定植于外周气道。
在体内平衡和修复过程中,基底细胞具有多谱系分化能力。因此,他们研究了在肺内气道定植的 KRT5 谱系标记细胞是否能够产生分化的子代细胞。对KRT5-CreER;tdTomato小鼠肺切片进行免疫染色分析,这些小鼠依次接受他莫昔芬和 NTCU 治疗,结果显示支气管和细支气管沿线区域内衬有看似假复层的 tdTomato+上皮。这些 tdTomato +区域包含基底细胞、分泌细胞和纤毛细胞,分别通过 KRT5、SCGB1A1 和乙酰化 α-微管蛋白 (ACT) 的表达进行评估。这表明,诱变剂处理后向远端扩张的基底细胞亚群至少有一部分仍具有分化能力,从而揭示了高度异常的基底细胞可能通过其建立包含组织学正常上皮的各种细胞类型的癌化域的机制。研究发现,KRT13 的表达在扩张的 tdTomato+结构域的前沿以及鳞状病变中富集。
为了评估基底细胞扩展到肺内气道时的克隆动态,他们将系统发育树与其解剖信息相结合,将克隆映射到进行相关微活检的上皮区域(图 6B-C)。从这些分析中得出几个观察结果。首先,当关注 MD7047 时,他们检测到四个主要谱系分布在数毫米的肺上皮上(图 6B-C)。其次,在肺中检测到的所有克隆都与共同祖先有关,而近端气道在克隆组成方面似乎更加异质。第三,每个主要谱系的后代所占据的空间区域基本上是独有的,尽管它们在空间上彼此接近。因此,在 MD7047 的右肺中,不同的克隆在不同的肺叶中定植(图 6B)。这些观察结果与应用于气道的非中性克隆扩增理论一致,该理论预测随着克隆在单个气道中定植,克隆异质性会降低。重要的是,克隆空间分布的这些特征都在 MD7047 的其他肺叶以及另一个体 MD6812 中得到了复制(图 6C)。与其他克隆相比,主要谱系并未显示出特别高的突变数量,它们有时会出现驱动突变(图 5C)。总之,这些数据表明,NTCU 治疗小鼠的肺主要由少数谱系组成。这些克隆细胞占据的领地具有排他性,这表明单个肺叶是由来自共同祖先的细胞群独特地定植的。
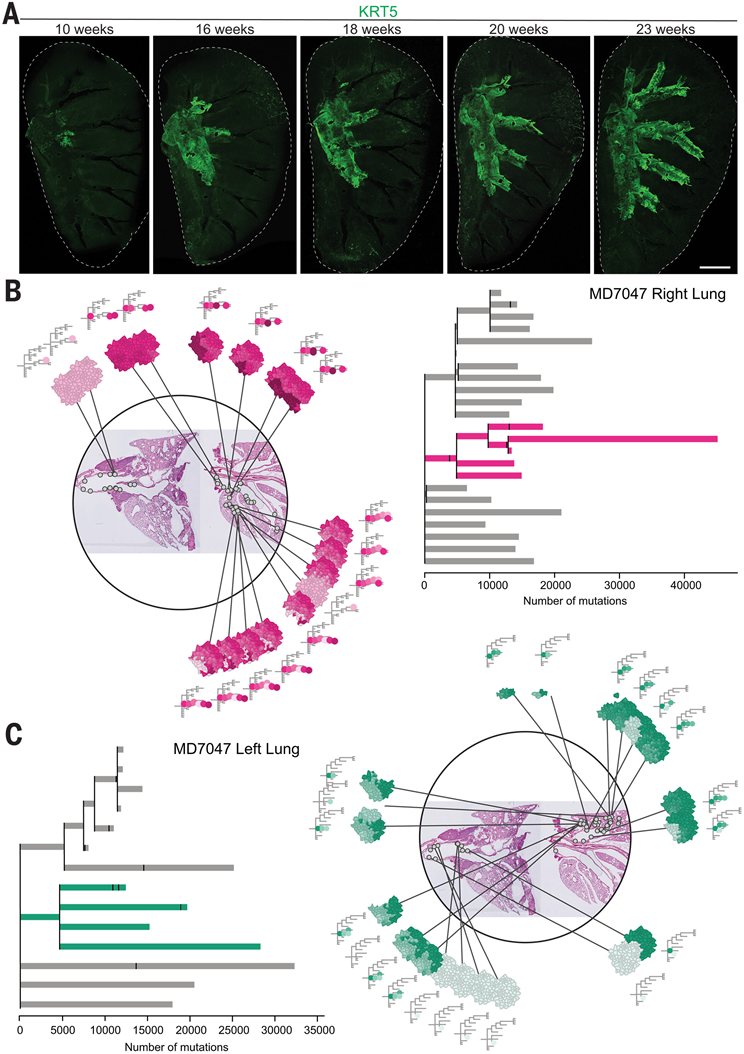
图6. NTCU 驱动的肺内克隆扩增。
(A) 从 NTCU 治疗开始后不同时间点收集的全肺的 3D 投影。(B) 小鼠 MD7047 的气管和肺中选定克隆的位置和相应的微活检的综合可视化。(C) 与 (B) 相同,但涵盖了小鼠 MD7047 气管和左肺的所有样本。
07
不同解剖部位人类侵袭前肺病变的克隆相关性
公开的研究提出,在人类支气管上皮的广泛分散部位存在克隆相关的癌前病变,支持存在癌化区域。已有的纵向分析表明,病变前体细胞的迁移有助于沿气管支气管树形成该区域。他们在 NTCU 模型中的发现与这一观点一致。为了进一步探索这一点,他们使用多位点测序来研究伦敦大学学院医院监测研究中招募的五名患者中解剖学上不同的癌前病变之间的克隆关系。使用 LCM 富集了组织学范围从中度发育不良到 CIS 的活检上皮组织,并进行了WES,中位深度为 431 倍。他们分析了这些供体的12个区域,发现5个个体中有4个存在空间差异的侵入前气道病变之间的克隆相关性(图7A)。在P152患者中,主干事件跨越气管和左右支气管的病变(图7A),表明病变前体细胞可以双侧扩散。
为了阐明不同位点间体细胞事件的动态变化,他们使用 CONIPHER 技术为每位患者构建了系统发育树,该软件整合了狄利克雷聚类和体细胞突变拷贝数误差校正。在这些系统发育树中,包含大部分聚类归类为截短突变,其余聚类则归类为亚克隆突变(图 7B-C)。虽然由于患者队列规模较大,对肺癌基因突变选择的分析效力不足,但TP53突变是最显著的选择截短突变,存在于 100% 的克隆相关位点中。在存在克隆相关病变的患者中,克隆性躯干突变的比例为26.4%至78.8%,而亚克隆突变的共有频率为6.4%至15.4%(图7B-C)。已鉴定的区域间克隆多样性表明,细胞在位点间迁移时会随着时间的推移积累额外的突变。一位患者P149出现了两个解剖上独立的病变(LUL/LLL和RLL),它们独立出现,每个病变都包含不同的TP53突变。
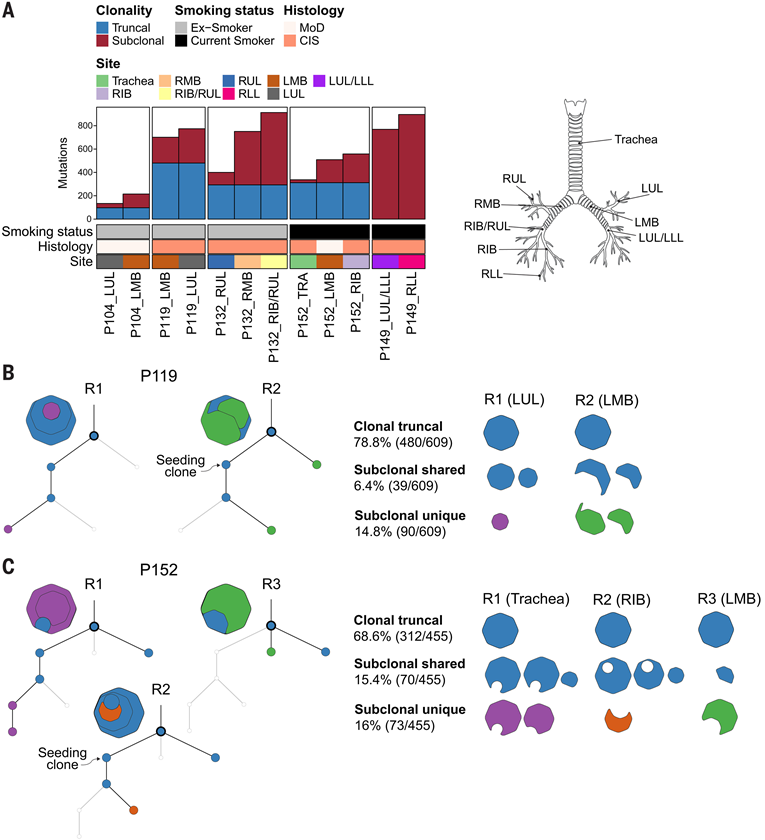
图7. 解剖学上不同的人类癌前肺病变之间的克隆相关性。
(A) 用于评估克隆性的癌前样本和患者特征的总结。(B) 基于体细胞突变的系统发育树,显示了戒烟患者体内两种惰性病变的克隆关系和进化史。(C) 系统发育树描述了当前吸烟者体内惰性和进行性病变之间的克隆关系。
+ + + + + + + + + + +
结 论
本研究使用致癌物诱导的 LUSC 模型,未添加任何基因突变或细胞类型偏好,发现致癌物暴露会导致基底细胞之间发生非中性竞争、异常克隆扩增以及气道内基底细胞的动员。最终,肺鳞状细胞癌变病变由少数高度突变的克隆发展而来,这些克隆在大部分支气管系统中占主导地位。对人类患者的多位点测序证实了不同气道区域存在克隆相关的肺鳞状细胞癌变病变。本研究确定了基底细胞克隆动态的转变以及相关的基底细胞命运的转变,这些是肺部区域癌变的驱动因素。
+ + + + +



 English
English


