文献解读|Nat Commun(14.7):肠道组织微环境中宿主微生物组解析的多组学空间框架
✦ +
+
论文ID
原名:A multi-omics spatial framework for host-microbiome dissection within the intestinal tissue microenvironment
译名:肠道组织微环境中宿主微生物组解析的多组学空间框架
期刊:Nature Communications
影响因子:14.7
发表时间:2025.01.31
DOI号:10.1038/s41467-025-56237-7
背 景
宿主免疫系统与其微生物组成分之间错综复杂的相互作用会随着肠道组织环境的扰动而发生动态变化。了解肠道组织微环境内微生物群、上皮和免疫细胞之间复杂的相互作用对于理解健康系统的维持以及各种疾病的病理机制至关重要。
实验设计
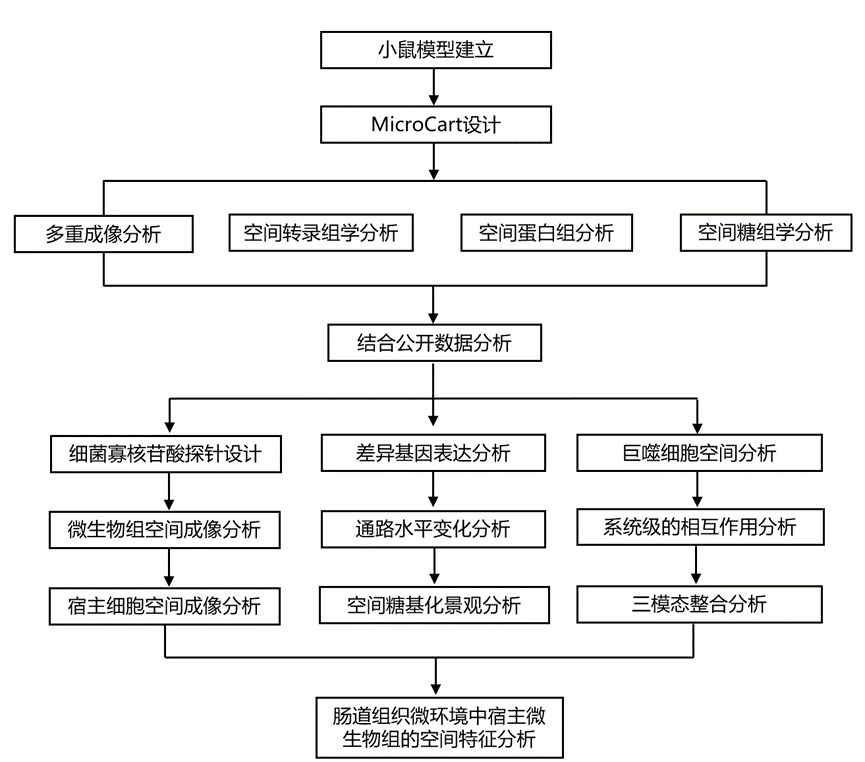
结 果
01
细菌寡核苷酸探针的稳健设计和有效验证MicroCart 的总体研究设计
研究团队引入了微生物组制图(MicroCart),这是一个旨在弥合宿主-微生物组相互作用与空间分析之间的综合框架。MicroCart 包含一种优化的 16S 探针设计和验证方法,可高度特异性地靶向细菌类群,同时还可确保组织内各种生物靶标的共同保存,以便使用多重成像平台(多重离子束成像:MIBI)、空间测序模式(Nanostring GeoMx 数字空间分析:DSP)和质谱成像技术(N-聚糖的 MALDI-MSI 成像)进行下游研究,从而能够在任何生物模型中对宿主-微生物组相互作用进行全面和多组学的空间分析。
MicroCart 允许对包含完整微生物成分的目标组织进行详细研究,例如本研究中的小鼠结肠炎模型中的肠道组织(图 1A):简而言之,他们通过在饮用水中加入 3.5% 葡聚糖硫酸钠盐(DSS)连续 6 天来诱发小鼠结肠炎。结肠炎组共包括 4 只小鼠,而 4 只小鼠作为饮用正常水的健康对照组。从小鼠实验中收集的肠道组织可采用各种空间组学技术进行研究,包括同时探测(1)使用抗体和 16S 特异性探针对微生物和宿主成分进行 MicroCart-MIBI 成像(图 1A),(2)使用定制的 16S 特异性探针进行 MicroCART-GeoMx 空间转录组学分析(图 1A),以及(3)使用MALDI-MSI方法(图 1A)对来自同一组织的连续切片进行三模态空间分析,探究原位研究宿主-微生物相互作用(图 1B)。
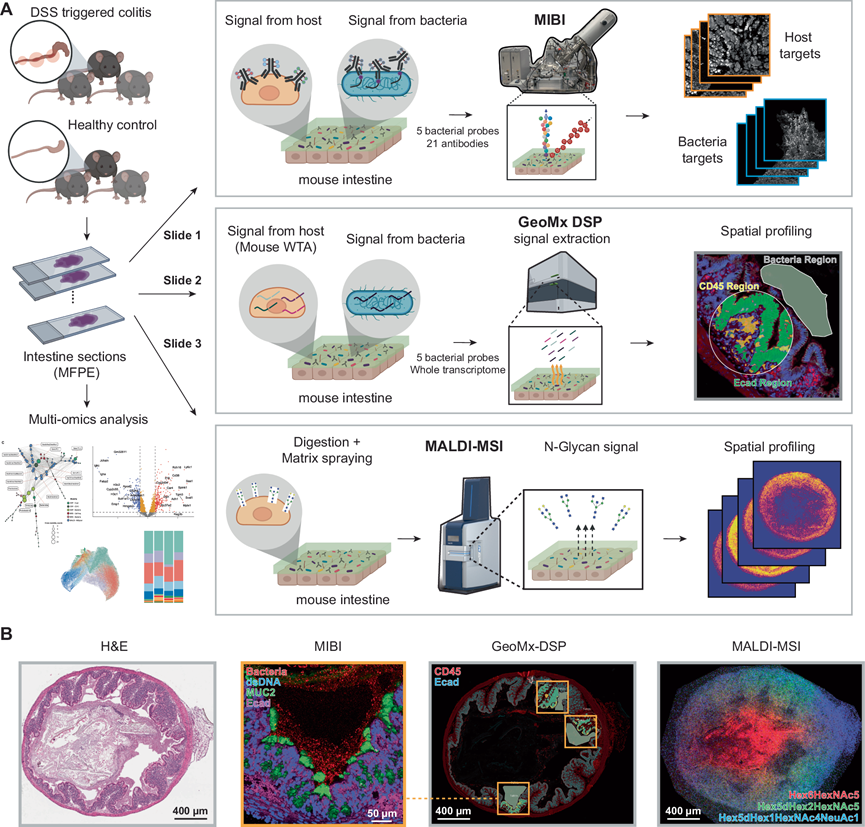
图1.研究概述。
(A)研究示意图。(B) 代表性的图像肠组织切片,具有三种不同的模式。
02
细菌寡核苷酸探针的稳健设计和有效验证
研究团队采用了一项策略,该策略涉及构建一个精选的 16S rRNA 序列池,该池仅由肠道微生物组中的已知细菌组成,总计 12936 个近全长的 16S rRNA 序列。然后,他们使用系统发育序列搜索器 ARB 从这个精选序列池中识别符合用户定义的细菌目标群的覆盖率和特异性要求的特征序列。随后,这些由 ARB 确定的候选特征序列将根据多项标准进行额外的过滤和筛选,包括熔化温度、杂交效率和预测的二级结构。满足上述所有标准的探针将予以保留。对于较低系统发育水平(例如物种水平)的目标群体,使用单个寡核苷酸探针。然而,对于更高的系统发育水平,如门级,由于目标组中的序列数量众多,单个探针通常无法提供令人满意的覆盖率和特异性。因此,他们采用了额外的组合探针组策略,其中从上一步中选择的多个探针组合成三个一组。然后通过计算机评估这些探针组合以获得最佳覆盖率和特异性,其中使用 Usearch 平台将探针与精选的 16S rRNA 序列池进行快速序列比对进行。在此步骤之后,建议在保持特异性的同时实现最高覆盖率的探针组合组进行实验验证(图 2A)。MicroCART 的探针设计组件能够快速设计针对各个层次微生物组成分的高度特异性 16S 探针。
将 MicroCart 的计算机模拟流程与严格的实验验证框架相结合对于确保探针的质量、特异性和可靠性至关重要。验证细菌 ISH 探针的传统方法包括培养细菌培养物,并使用标记的候选探针进行明场或荧光 ISH 染色。然而,这个过程不易扩展。为了应对这一挑战,他们在 MicroCart 中引入了一个高效的细菌探针验证流程(图 2B)。他们首先培养多种相关和不相关的肠道微生物组细菌物种(图 2B),每种物种在其特定的所需培养基中生长,并根据需要在厌氧条件下生长。培养后,收获细菌并离心以获得细菌沉淀。然后使用卡诺氏固定液固定细菌沉淀,随后在卡诺氏固定液和福尔马林中固定。为了进一步保持固定细菌沉淀的结构完整性,他们将它们嵌入 Histogel 中。最终将固定和组织凝胶包埋的不同物种的细菌沉淀物以阵列形式排列在组织盒中,并包埋在石蜡中以创建甲基卡恩和福尔马林固定石蜡包埋 (MFPE) 细菌微阵列 (BMA)。MFPE-BMA 允许重复切片和分析,无需重复培养细菌,同时保持固定条件与最终感兴趣的组织相同,以实现最大兼容性。通过使用 MFPE-BMA 载玻片,可以使用传统的荧光初级探针验证探针,或者使用类似于 Oligopaints 的初级和次级寡核苷酸染色方案来验证探针,以提高成本效益,其中所有经过测试的候选探针可以共享一个保守的次级检测条形码,从而减少所需的荧光标记检测探针的数量(图 2B)。最重要的是,这些对照 MFPE-BMA 切片同时包含多种细菌物种,可作为 ISH 特异性和检测性能的组合阳性和阴性对照。使用 MicroCart 中改进的细菌探针设计和验证流程,他们能够设计和验证针对不同系统发育水平群体的探针。在门级,他们设计了针对厚壁菌门和拟杆菌门的探针(图 2C)。同时,他们还设计和验证了针对各种物种级益生菌类群的单寡核苷酸探针,这些益生菌包括:嗜酸乳杆菌、副干酪乳杆菌、罗伊氏乳杆菌、乳酸乳球菌、植物乳杆菌、鼠李糖乳杆菌和长双歧杆菌长亚种(图2C)。使用 MicroCart 流程设计的探针在两个层面上均表现稳健,仅在目标组中观察到荧光信号,而在其它组中未观察到,并且在序列相似性相近的细菌中脱靶结合有限。

图2. 探针设计和验证。
(A) MicroCart 计算机探针设计过程示意图。(B) 设计探针的实验验证过程说明。(C) 左图:在 BMA 载玻片上进行实验验证,探针设计用于靶向门类(拟杆菌门或厚壁菌门)。右图:探针设计用于靶向各种益生菌种。
03
使用 MicroCart-MIBI 对微生物组和宿主细胞进行多重成像
接下来,他们将使用 MicroCart 流程生成的探针调整到多路复用成像平台上,以 MIBI-TOF 为例,这是一种成像平台,能够使用二次离子质谱结合飞行时间读数进行 >40 重空间分析,以亚细胞分辨率解析组织切片中的金属标记标签。为了进一步扩增寡核苷酸靶标以获得最佳信噪比,他们调整了基于金属偶联抗体的方法,通过靶向标记抗体(该抗体针对与 16S 靶向寡核苷酸共价标记的半抗原),以实现超越标准金属标记寡核苷酸的信号放大。这使得能够与针对目标半抗原的抗体结合在 MIBI-TOF 上稳健地检测细菌信号。为了准确定位微生物组和宿主成分的空间模式,他们还进一步改进了微生物组相关组织的固定方法。通常建议使用甲基卡恩固定来保存组织样本中的粘液结构和细菌定位,但这种方法对于蛋白质表位的保存不如福尔马林固定石蜡包埋(FFPE)有效,FFPE 是目前广泛用于标准临床组织学和空间平台(包括 MIBI-TOF)的组织保存临床标准。他们假定适合 MicroCart 的优化固定方法理想情况下应该包含两种固定剂:首先使用甲基卡恩来保存粘膜层和其中的细菌成分,然后用福尔马林来理想地保存蛋白质表位。这种方法称为甲基卡恩和福尔马林固定、石蜡包埋(MFPE),经验证能够同时保存粘膜层和蛋白质表位。
首先使用携带共价连接半抗原的 MicroCart-oligos 对 MFPE 组织切片进行 ISH,然后用包括特异性结合这些半抗原的抗体的 MIBI 抗体鸡尾酒组合进行染色,从而能够同时对宿主蛋白和细菌成分进行成像(空间蛋白组学分析)(图 3A)。他们对 DSS 处理和健康对照小鼠的肠道组织进行了总共 202 个视野(400um × 400um;FOV)的 MIBI 成像 ,共鉴定出 126426 个宿主细胞,包括小肠和大肠内的各种免疫细胞和上皮细胞类型(图 3B)。他们观察到结肠炎期间肠道细胞群体的组成发生了显著变化(图 3C-D),包括 DSS 诱发的结肠炎中小肠和大肠中的浆细胞数量减少,以及小肠和大肠中免疫细胞的整体增加,这反映了对结肠炎的免疫反应的局部性。
接下来,他们使用滑动窗口策略量化了结肠炎期间细菌成分的空间变化,重点关注整个肠道 FOV 的定量空间变化(图 3E)。他们首先评估了每个滑动窗口内每个 MIBI FOV 中非宿主区域中粘膜大小与细菌斑块的比率。较高的值表示宿主粘液和细菌群落之间的局部混合增加。患有结肠炎的小鼠表现出明显更多的宿主和细菌细胞局部混合,反映了与 DSS 诱导的结肠炎相关的潜在微生物相关重塑和屏障穿透(图 3F)。接下来,他们根据MicroCart ISH 探针评估了各种细菌门的局部 Shannon 熵,其中较低的熵值反映了局部微生物组成多样性的降低(图 3G)。总之,这些结果凸显了 MicroCart 与高度多路复用成像相结合的能力,可用于在小鼠结肠炎模型中多模式解剖宿主微生物重塑和空间重组。
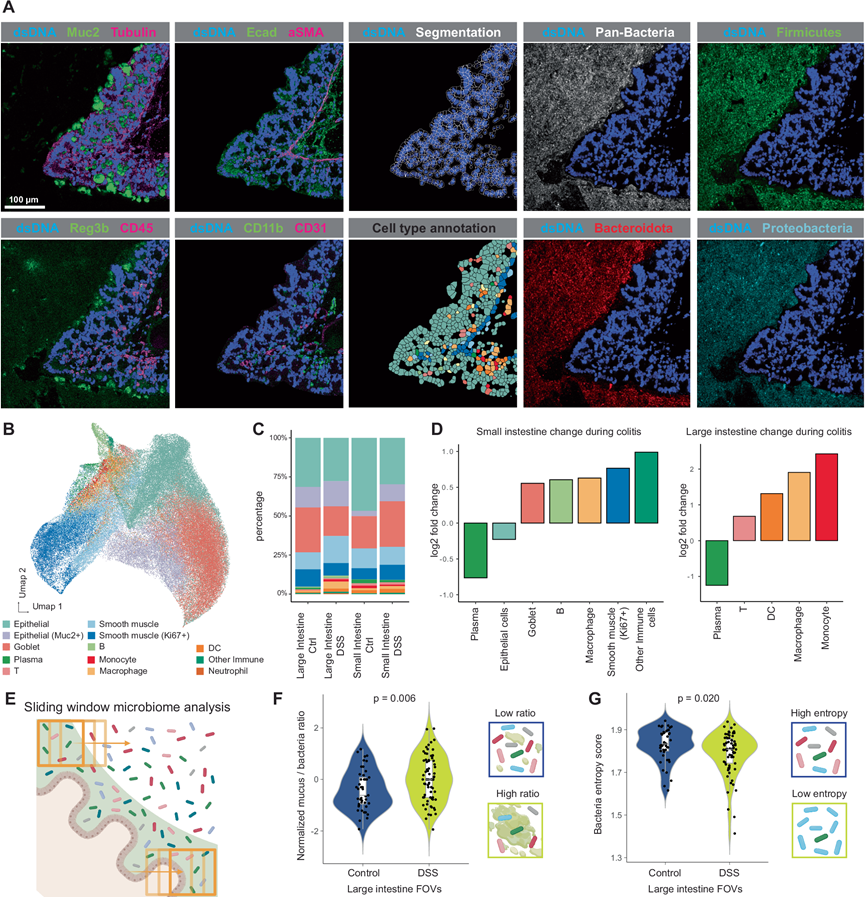
图3. 使用 MicroCart 进行空间蛋白质组学分析。
(A) 来自代表性组织区域(大肠)的图像,显示来自宿主细胞或微生物组群落的选定 MIBI 信号、细胞分割和细胞类型注释信息。(B)UMAP可视化。(C) 每个组织样本的细胞类型比例,按组织位置和结肠炎状态分组。(D) 与结肠炎和健康组织相比,细胞类型频率变化显著。(E) 窗口微生物组分析的插图。(F) 小提琴图和说明对照或结肠炎大肠组织样本中的局部粘液细菌比率。(G) 小提琴图和说明对照或结肠炎大肠组织样本中的局部细菌Shannon熵。
04
使用 MicroCart-DSP 对宿主和微生物组进行空间转录组分析
为了正交验证细菌探针特异性(图 2C),他们为空间转录组学 Nanostring GeoMx DSP 平台开发了一个定制的工作流程,在 MFPE-BMA 切片上使用 MicroCart-DSP 定制探针,成功地使用下一代测序 (NGS) 作为这些 MicroCart 条形码上唯一 UMI 的读数,确认了 MicroCart-DSP 探针对其目标门类的特异性(图 4A),突出了 MicroCart 设计的探针在空间成像和测序方面的跨平台实用性。鉴于 MicroCart-DSP 定制探针原位的可行性,他们接下来开发了一种定制工作流程,将小鼠全转录组图谱 (WTA)(> 20000 个基因)探针组与 MicroCart-DSP 定制探针相结合,以分析健康和结肠炎小鼠肠道之间的细胞通路、免疫信号传导、代谢状态和微生物组成变化,按 CD45 阳性(免疫)、E-钙粘蛋白阳性(非免疫上皮)和细菌区域分层。他们使用这种方法对总共 350 个区域进行测序,每个 ROI 的平均基因计数为 405000。与MFPE-BMA 结果类似,小鼠组织空间转录组结果也证实了细菌信号的特异性(图 4B)。
利用这种 MicroCart-DSP 方法能够进一步研究结肠炎期间宿主-病原体反应(图 4C)。在小肠区域,他们观察到 Reg3 家族(Reg3b和Reg3g)基因表达增加,这两个基因之前均在结肠炎期间的抗菌活性和组织修复中发挥重要作用。他们还观察到同工酶Duox2和Duoxa2基因表达增加,此前已发现它们与人类患者的 IBD 有关,以及 Sprr2 家族(Sprr2b、Sprr2i和Sprr2h)的基因表达增加,提示存在针对革兰氏阳性菌的特异性抗菌反应,表明结肠炎期间小肠内细菌群落组成发生破坏。同时,在大肠中,他们观察到包括髓系细胞标志物Ly6c1在内的基因表达增加,浆细胞相关基因(Igkc、Igha和Jchain)表达减少,这与本研究对 MIBI 的观察结果一致,即结肠炎期间大肠中巨噬细胞和单核细胞浸润增加,浆细胞减少(图 3D)。Saa1基因表达增加进一步凸显了巨噬细胞在大肠急性炎症中的关键作用。
接下来,他们进行了区域特异性转录组分析,以更好地了解小鼠小肠和大肠在结肠炎期间免疫(CD45+)和非免疫(Ecad+)区域的通路水平变化。他们首先对 GeoMx 空间转录组数据进行基因集富集分析(GSEA),观察到与外源抗原的抗原呈递相关的通路的富集,以及 CD45+ 免疫区室中另一种生物体的细胞的死亡,这反映了对结肠炎期间潜在的粘膜破坏和细菌成分暴露的协同免疫反应。在小肠的 Ecad+ 区域中,上皮细胞中富集的通路也主要与结肠炎期间的各种防御途径(包括细胞焦亡等)相关(图 4D)。相反,在大肠内,CD45+ 免疫区域表现出免疫反应的富集,涵盖与粒细胞、白细胞迁移、趋化性和活化相关的通路。在 Ecad+ 区域中,富集的通路包括免疫反应和代谢过程(图 4D)。这些结果突出了小鼠结肠炎模型中 DSS 处理后小肠和大肠局部区域的多种免疫反应和不同的代谢变化。
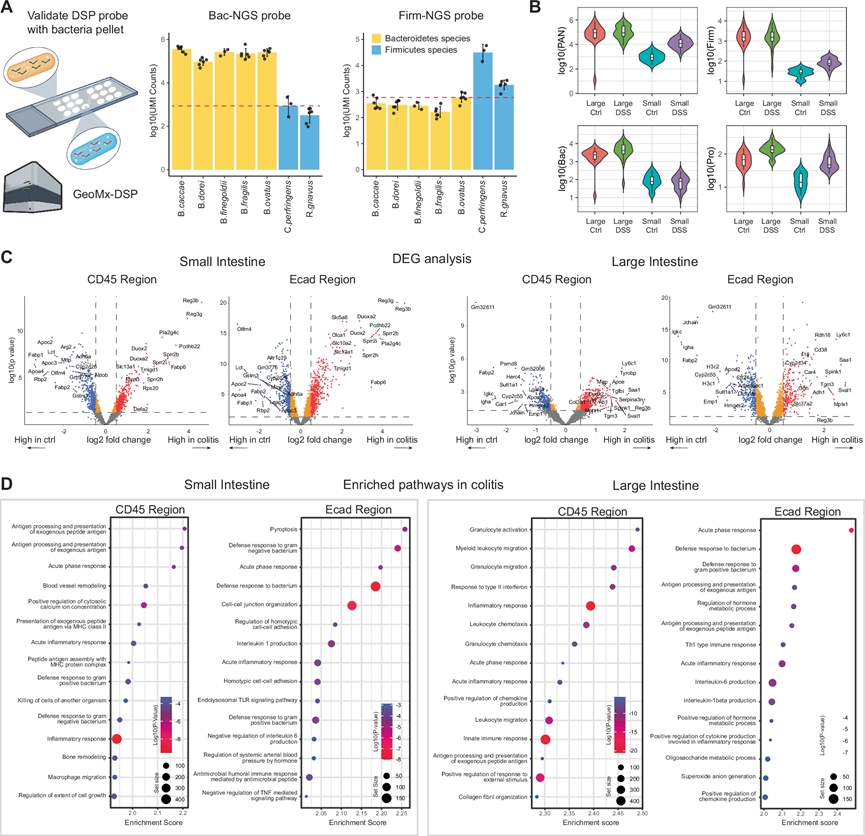
图4. 使用 MicroCart 进行空间转录组学分析。
(A) 左:BMA 上细菌探针验证方案说明,使用 MicroCart-DSP 空间测序作为读数。右:条形图显示不同细菌物种阵列中各自探针的测序计数。(B) 小提琴图显示细菌探针信号水平。(C) 火山图显示健康和结肠炎样本之间宿主细胞表达差异最大的基因。(D) GSEA分析显示结肠炎组中前 15 个富集的通路。
05
MALDI-MSI 检测结肠炎期间肠道整体糖基化转变
使用 UMAP 对 (1) 小肠和大肠以及 (2) 健康和 DSS 组织之间分层的每像素糖组成进行可视化,突出显示了物种、组织和疾病特异性的常见和独特糖基化模式(图 5A)。接下来,他们通过目视检测几种糖的数据证实了这些差异(图 5B)。进一步分析数据发现,健康和结肠炎组织之间存在显著的糖基化变化:在大肠组织中,结肠炎期间 Hex4HexNAc3、Hex4HexNAc4、Hex5HexNAc5、Hex5HexNAc4 和 Hex6dHex1HexNAc5 显著增加。相反,在小肠组织中,他们观察到结肠炎期间 Hex7HexNAc6、Hex5HexNAc5NeuGc1、Hex6dHex2HexNAc5、Hex5HexNAc6NeuGc1 和 Hex6HexNAc6 显著减少(图 5C)。先前的研究发现肠道炎症与截短和未成熟的表面聚糖表达上调之间存在关联,他们在研究中检测到 DSS 肠道组织中低分支 N-聚糖增加,高分支 N-聚糖减少(图 5C)。接下来,他们采用了像素级聚类方法(基于 N-Glycan 信号)来识别 20 个空间上不同的糖基化群体(图 5D-E)。Hex3dHex1HexNAc4、Hex3dHex1HexNAc2 和 Hex3dHex1HexNAc3 在大肠中富集,如在结肠炎期间聚类 2和 15显著减少,而聚类7增加。在结肠炎期间,小肠中 Hex5HexNAc6NeuGc1、Hex5dHex1HexNAc6NeuGc1 和 Hex6dHex3HexNAc6 发生富集,以聚类 1和聚类 6的显著减少为代表,而聚类 11的增加为代表(图 5F)。
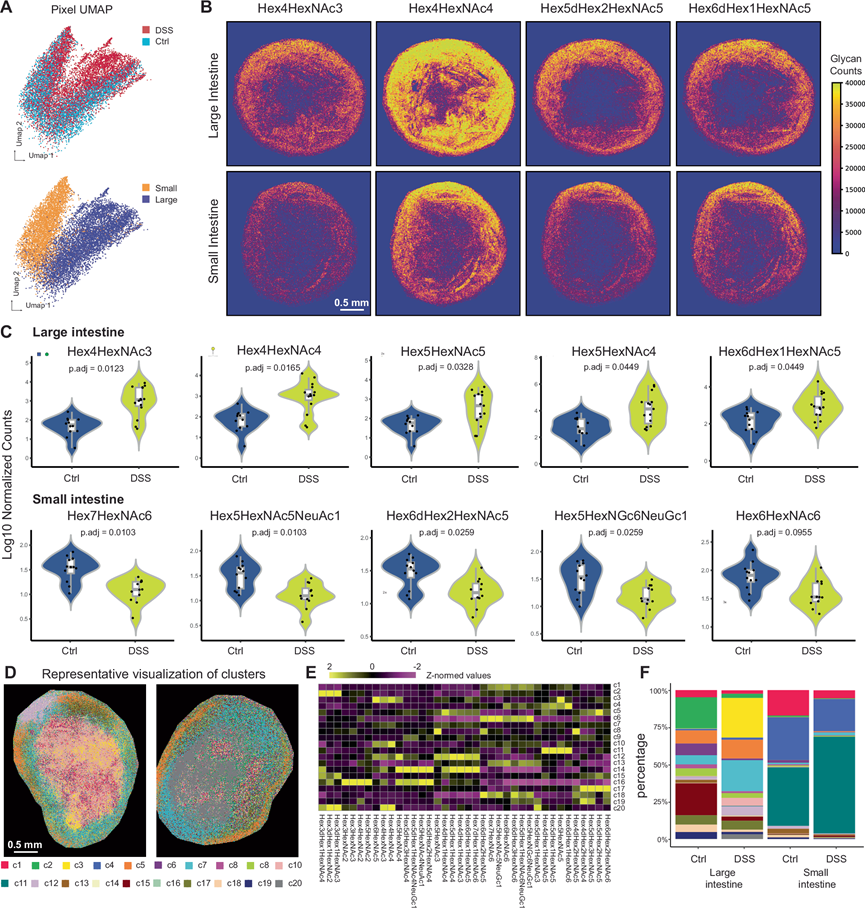
图5. 相邻载玻片上的空间糖组学。
(A) 基于来自 MALDI-MSI 的像素级 N-糖信号,对结肠炎状态或组织类型信息进行 UMAP 可视化。(B) 小肠和大肠组织的选定 N-糖信号的代表性图像。(C) 康和结肠炎状态下小肠和大肠组织中变化最显著的 5种N-糖。(D) 基于 N-糖信号的聚类结果的代表性图像。(E) 每个像素级聚类的平均 N-糖水平热图。(F) 跨结肠炎状态和组织位置的每种组织的聚类百分比。
06
结肠炎巨噬细胞的多组学空间分析
到目前为止,从 MicroCart-MIBI 和 -DSP 相邻切片来看,结肠炎期间大肠中单核细胞和巨噬细胞的浸润增加(图 3D和图4D)。他们观察到巨噬细胞和单核细胞占据固有层/粘膜下层周围空间分层的生态位,并且与肠肌层中增加的 aSMA 共定位的趋势(图 6A),提示结肠炎期间存在协调的、空间定位的免疫反应,包括结肠炎扰动后成纤维细胞反应的可能性。对 MicroCart-DSP 数据中 CD45 区域的进一步分析也产生了更多胶原相关基因(Col1a1、Col1a2、Col3a1、Col18a1、Col4a1和Col5a1)以及单核细胞相关基因(S100a8、S100a11和Ly6c1),巨噬细胞和单核细胞与肠道平滑肌细胞的接近度增加和渗入增加。在高巨噬细胞和单核细胞浸润 FOV 中,与所有其他大肠区域相比,平滑肌增殖和迁移相关基因特征增加(图 6B),巨噬细胞和单核细胞趋化性相关基因特征增加(图 6B)。与更多分层条件相比,平滑肌增殖、迁移以及巨噬细胞和单核细胞趋化性的进一步微小特征也支持了这些结果。他们推断,巨噬细胞和单核细胞群体浸润到这些区域可以启动结肠炎中进一步的下游免疫相互作用和重塑,巨噬细胞和单核细胞之间的相互作用增强,并且大多数细胞类型均可以通过 MicroCart-MIBI 识别(图 6C)。
为了确定与巨噬细胞和单核细胞浸润区域中的这种功能性转变相关的免疫细胞通路和状态,他们首先利用 GSEA 来确认 CD45+ 免疫区内巨噬细胞活性的上调。在成对的 E-Cadherin+ 上皮区域中,他们观察到与细菌组成和微生物相关免疫抑制特别相关的多种通路的激活,包括金属离子隔离、对微生物的体液免疫反应和过氧化氢分泌。这些结果支持一种模型,在该模型中,巨噬细胞和单核细胞浸润充当前线宿主防御机制,以抵御在结肠炎期间突破物理上皮屏障的细菌成分(图 6D)。
接下来,他们研究了配对 CD45+ 和 Ecad+ 组织区域内基因程序之间的关系,以在系统层面上了解免疫上皮在响应微生物浸润时的相互作用。他们首先使用一致的非负矩阵分解 (cNMF) 方法 从MicroCart-DSP 数据中识别出不同的基因程序,并对配对的免疫和上皮区域之间的这些基因程序进行了相关性分析。有趣的是,与其他大肠区域相比,巨噬细胞和单核细胞浸润量较多的区域(通过 MIBI 检测到)表现出更多聚集的相关基因程序“热点”(图 6E),表明在空间层面上存在协调的免疫反应。他们通过对热点内富集的这些基因程序中贡献最大的基因进行GO分析,进一步研究了这些已识别的 Ecad 和 CD45 区域相关热点的功能,确定了与免疫反应、免疫细胞群体趋化性、吞噬作用和细胞清除相关的通路(图 6F),表明巨噬细胞和单核细胞浸润是小鼠肠道结肠炎期间多种免疫上皮组织相互作用的一个节点。
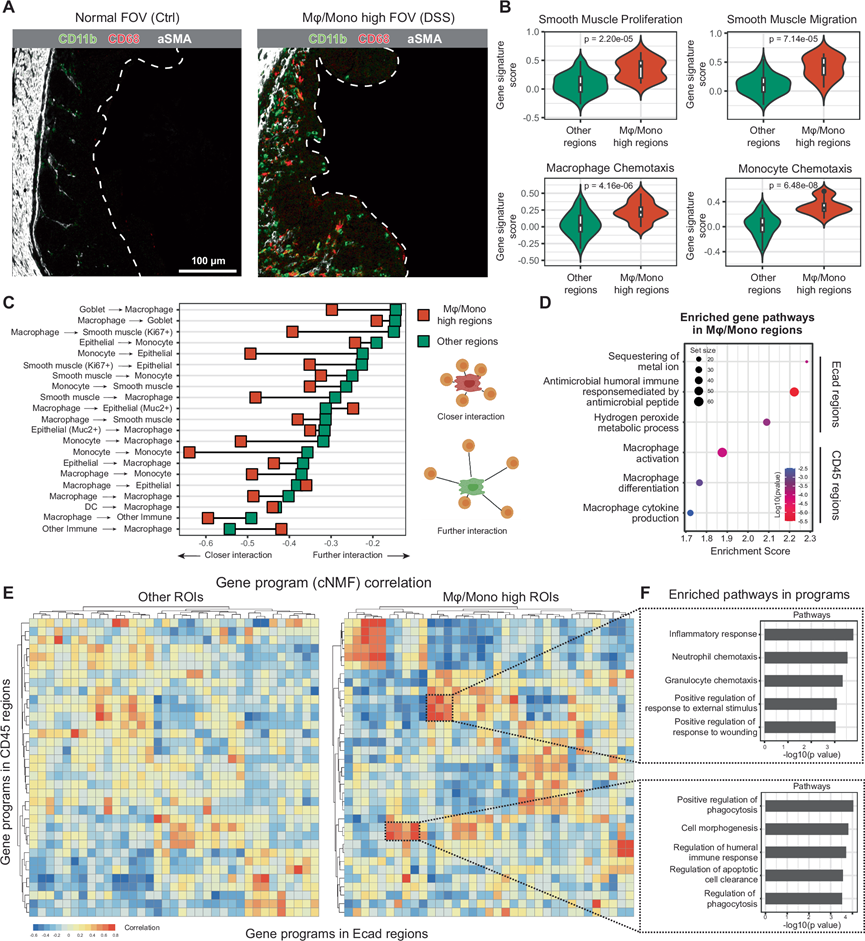
图6. 巨噬细胞的多组学分析。
(A) 未由巨噬细胞和单核细胞浸润的组织区域的代表性 MIBI 图像(左)和有大量巨噬细胞和单核细胞浸润的区域(右)。(B) MicroCart-DSP 区域的基因通路得分小提琴图,按巨噬细胞和单核细胞浸润状态分隔。(C) 与巨噬细胞/单核细胞和大肠组织中其他细胞类型之间的随机背景排列(1000次迭代)相比,成对细胞-细胞相互作用的哑铃图发生富集或缺失,并根据巨噬细胞/单核细胞浸润状态分离。(D) 对高巨噬细胞/单核细胞浸润区域进行 GSEA 分析。(E) 在配对 CD45 和 Ecad MicroCart-DSP 区室之间识别的基因程序相关性热图。(F)GO分析。
07
空间三模态整合用于结肠炎的系统级分析
生成的三模态 MicroCart 空间组学数据具体包括 (1) MIBI:细胞表型、微生物组成和频率信息,(2) DSP:区室特定的全转录组和微生物定量,以及 (3) MALDI-MSI:N-糖水平。鉴于数据的规模各不相同(图 1B),他们首先在单个 FOV 级别手动对齐三模态数据,以最大限度地提高下游结肠炎样本多组学研究的一致性。鉴于糖分支途径与代谢物通量之间的联系,最初的研究重点是各种代谢途径的通路富集分数与组织区域内不同糖表达水平之间的相关性。他们首先确定了对 N-糖表达很重要的关键代谢通路,包括与果糖、肌苷和 NAD 相关的通路(图 7A)。此外,他们将氧化应激与糖表达的变化联系起来(图 7A)。进一步研究发现,上皮细胞和树突状细胞频率与聚糖 Hex5HexNAc5NeuGc1 和 Hex4dHex1HexNAc5 之间存在统计学上显著的正相关性,而增殖平滑肌细胞频率与 Hex5dHex2HexNAc4 之间存在显著的负相关性(图 7B),表明肠道组织中关键细胞类型特异性因子及其糖基化状态的募集和消耗。
接下来,他们研究了宿主对 DSS 诱发的结肠炎期间微生物浸润的反应,特别在结肠炎组织中观察到,杯状细胞频率与细菌局部粘液比率呈正相关(图 7C),与 MUC2+ 上皮细胞呈负相关(图 7C,左下),局部粘液比率之前定义为 MIBI 中细菌和粘膜信号的混合(图 3F)。他们在健康对照样本中没有观察到显著的对应关系(图 7C),还观察到单核细胞频率与结肠炎特有的局部细菌 Shannon 熵之间呈负相关,T 细胞频率与健康对照特有的局部细菌熵之间呈负相关(图 7C)。这些结果强调了宿主对局部微生物相互作用的结构化反应,这促使他们进一步研究细菌与宿主空间转录组变化之间的联系。由于细菌门组成不同,他们观察到了清晰的代谢特征(图 7D),包括具有磷脂酰乙醇胺和脂肪酸过程的厚壁菌门、具有脂质相关代谢过程的拟杆菌门和划分到非免疫 E-Cad+ 区域的具有磷脂酸和胆固醇过程的变形菌门(图 7D)。这些结果进一步验证了 DSS 处理后的宿主-微生物相互作用和下游效应。
为了从系统层面了解三种空间组学模式下的结肠炎,他们进行了相关网络分析,涵盖了所有测量的特征(图 7E)。该分析研究了不同特征之间的关联,并确定了肠道生物学中微生物-宿主相互作用的关键枢纽。他们构建的相关网络图结合了代表细胞群体频率和细菌信号强度 (MicroCart-MIBI) 的特征、奇异值分解 (SVD) 降维转录组主成分(MicroCart-DSP,以减少特征数量)和 N-聚糖表达 (MALDI-MSI)。在图中,节点表示特征,主干边(黑色) 表示基于 Spearman 相关性并通过最小生成树 (MST) 构建的特征之间的距离。连接两个节点的附加边(灰色)表示特征对之间存在显著的相关性。通过该网络,他们确定了关键的全局特征和跨模态的显著相关性,表明多种细胞类型、细胞状态、信号通路和糖基化模式与肠道系统中微生物渗透的协调宿主免疫反应有关。他们重点介绍的关键特征包括细菌信号、来自 E-Cad 和 CD45 区室的不同转录组特征以及不同的 N-聚糖,包括 Hex5dHex2HexNGc4、Hex5dHex2HexNGc5、Hex3dHex1HexNGc3。这个信息密度高的缩短特征列表对于未来吞吐量较低的结肠炎研究可能特别有价值。
接下来,他们尝试使用堆叠集成机器学习模型来预测结肠炎状态,这与之前关于集成学习应用于多组学数据的有效性的证明一致。他们首先为每种模态(空间蛋白质、RNA 和聚糖)训练三个单独的随机森林分类器来预测结肠炎状态。接下来,他们在这三个单独的分类器上应用随机森林集成学习层进行最终预测(图 7F)。与单模态分类器相比,这些结果支持多组学集成学习器是分类结肠炎状态的性能最高的模型(图 7G)。这些结果支持这样一种观点,即多种生物分子(包括蛋白质、RNA 和聚糖)参与了对疾病的协调免疫反应,正如这里的结肠炎所示。为了确定未来结肠炎研究中假设生成的关键特征,他们列出了分类器模型中跨模态特征的重要性得分(图 7H)。结肠炎分类器中值得注意的高重要性特征包括微生物特征(例如,变形菌)、E-Cad 区室中的基因表达以及上皮、树突状细胞和巨噬细胞的细胞频率(图 7H)。该分析表明,细菌信息(变形菌水平、总细菌水平)以及上皮组织基因表达谱的主要成分和上皮细胞频率可能是结肠炎状态的关键生物学标记。
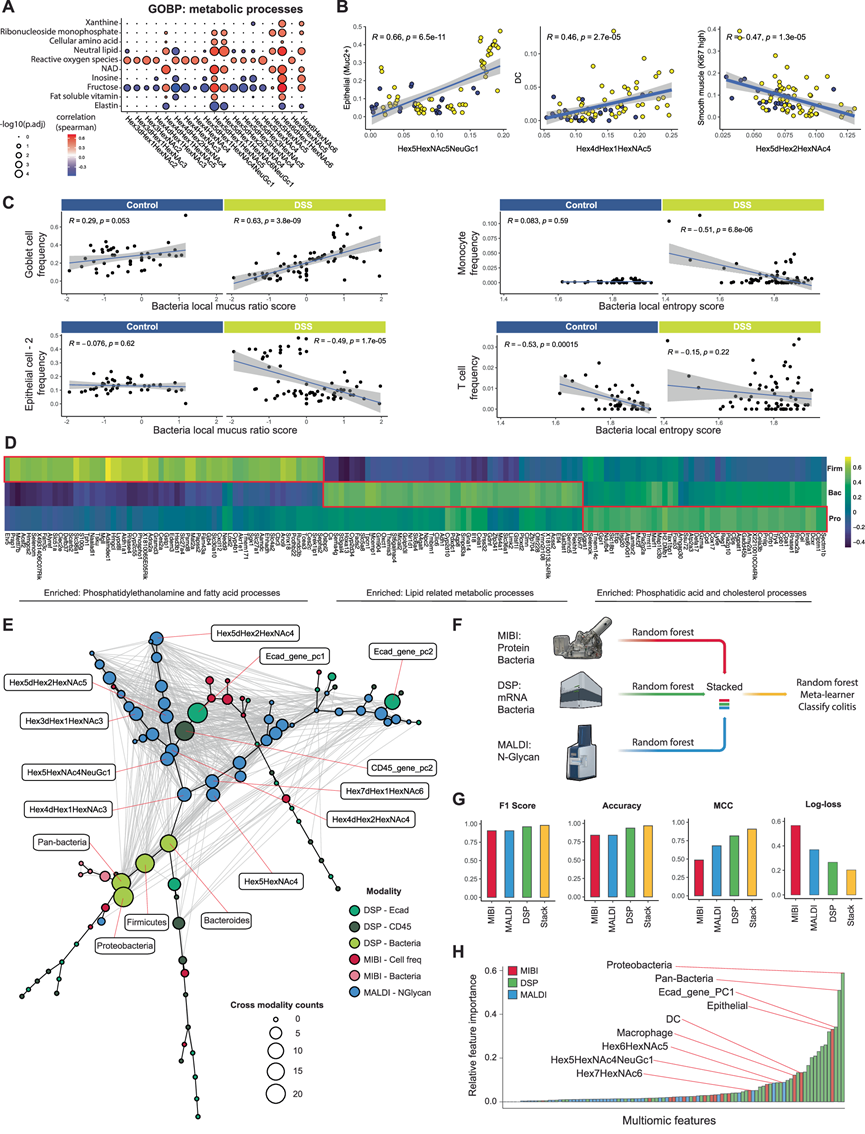
图7. 空间三模态整合。
(A) 基于相邻载玻片对齐的 FOV,MicroCart-DSP 和 MALDI-MSI 读数的代谢途径得分之间的相关性。(B) 基于相邻载玻片对齐的 FOV,点图显示 MIBI 和 MALDI 读数的细胞类型频率之间的相关性。(C) 点图显示来自 MIBI 的细胞类型频率与来自同一 FOV 的粪便区域中的微生物组空间指标之间的相关性。(D) 细菌信号(来自 MicroCart-DSP)与配对 E-Cad 区室(毗邻同一组织上的细菌区域)的宿主转录组信号之间的相关性。(E) 三种不同模态中特征的相关网络。(F) 三模态堆叠集成预测模型训练示意图。(G) 三模态堆叠集成预测模型的性能。(H) 来自随机森林分类器的相对特征重要性分数。
+ + + + + + + + + + +
结 论
本研究引入了MicroCart方法,这是一个跨多种空间模式同时原位探测宿主和微生物组的框架。通过使用空间蛋白质组学、转录组学和糖组学研究小鼠结肠炎模型中的肠道宿主和微生物组变化来展示 MicroCart。本项研究结果揭示了组织免疫反应的整体但系统性转变,包括响应宿主免疫和上皮细胞状态扰动、细菌种群转移、局部炎症反应和结肠炎期间代谢过程改变而发生的组织水平重塑。MicroCart 能够通过空间多组学深入研究宿主组织与其微生物组之间错综复杂的相互作用。
+ + + + +



 English
English


