文献解读|Signal Transduct Target Ther(52.7):呼吸道微生物群中口腔链球菌的富集可增强先天免疫力并预防流感感染
✦ +
+
论文ID
原名:Enrichment of Streptococcus oralis in respiratory microbiome enhance innate immunity and protects against influenza infection
译名:呼吸道微生物群中口腔链球菌的富集可增强先天免疫力并预防流感感染
期刊:Signal Transduction and Targeted Therapy
影响因子:52.7
发表时间:2025.08. 27
DOI号:10.1038/s41392-025-02365-x
背 景
社区获得性肺炎 (CAP) 因其高发病率和死亡率而成为世界范围内的重大公共卫生问题。CAP是一种在医院或医疗保健场所之外获得的肺部感染,可影响所有年龄段的人群,但在老年人、婴儿和有基础疾病的人群中尤为严重。根据2021 年全球疾病负担研究,下呼吸道感染导致全球约 250 万成年人死亡,是全球第五大死亡原因(若不包括 COVID-19 相关死亡,则为第四大死亡原因)。这些发现强调了制定有效 CAP 预防和治疗策略的迫切需要。
实验设计
结 果
01
CAP痰液宏基因组分析
研究团队招募了 38 名 CAP 患者进行纵向痰液收集,中位年龄为 68 岁,其中 21 名为女性。33 名健康对照者的中位年龄为 60 岁,其中 25 名为女性,14 名为当前吸烟者。两组主要由老年人组成。大约一半的参与者(38 人中的 17 人)在采集标本前接受了抗生素治疗。大多数患者的临床表现为轻度至中度,42.1% 不需要呼吸支持,50% 需要通过高流量鼻导管吸氧。 3 例患者应用了有创机械通气,其中 2 例在住院期间死亡。在 CAP 急性期的三个时间点共采集了 80 份痰液样本,随访期间采集了 9 份样本。SARS-CoV-2 是最常见的病原体,20 例(52.5%)患者呈阳性,其中一半患者(26.3%)同时检测到细菌。6 例患者(15.8%)检测到单独的细菌感染。6 例患者检测到真菌,大多数同时感染了 SARS-CoV-2 和/或细菌。FluA 队列由 22 例甲型流感感染患者组成,包括 12 例男性,中位年龄为 67.5 岁,其临床特征与 CAP 队列相似。
宏基因组测序平均每个样本产生 9.5 × 107 个高质量读段,所有样本的宏基因组覆盖率均大于 60%,并进行了细菌分类群分析。他们发现 CAP 患者入院时表达的 alpha 多样性低于健康对照组(图1b)。CAP 的较低多样性贯穿整个疾病阶段,急性期三个时间点之间没有显著差异,甚至在出院后 4 个月也可能低于健康对照组(图1c)。通过使用Bray-Curtis距离进行主坐标分析,他们发现CAP患者、健康对照者和同伴样本的痰液菌群组成存在显著差异(图1d)。此外,CAP患者中细菌之间的相互作用发生紊乱,呈现出块状结构,其内聚力低于健康个体。这些相互作用的复杂性已显著恢复,但即使在患者出院4个月后,其复杂性仍略低于健康对照(图1e-g)。
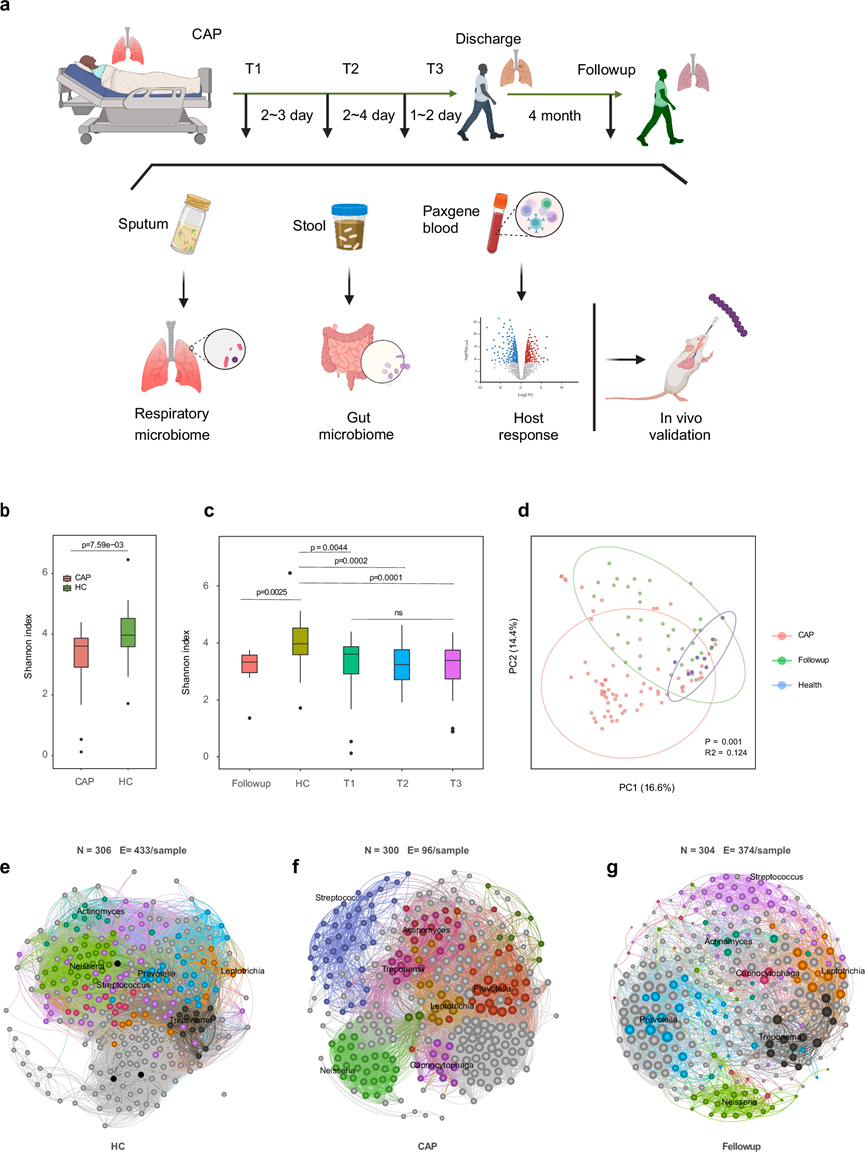
图1. 与健康对照组相比,CAP 患者的呼吸道微生物组具有明显差异。
(a) 研究设计概述。(b) 与健康对照组相比,CAP 患者入院时微生物多样性较低。(c) 降低的 alpha 多样性持续存在于整个病程中,甚至出院后 4 个月。(d) 基于 Bray-Curtis 距离的主坐标分析 (PCoA) 显示 CAP 患者、健康对照组和随访样本的痰液微生物组成存在显著差异。(e-f) 微生物共现网络。
02
呼吸道菌群失调在整个急性 CAP 阶段持续存在
在该队列研究的252种主要细菌(在至少20%的样本中相对丰度超过0.01%)中,与健康对照者相比,40种细菌在CAP患者中显著富集(图2a)。大多数富集的类群是呼吸道中常见的共生微生物。链球菌属是最常见的富集类群(n =16),其次是韦荣球菌(n=4)和普雷沃氏菌(n =4)。值得注意的是,在最近一项涉及917名CAP患者和25名健康对照者的大规模研究中,这三个属也位列CAP患者中富集的前四个属之列。10 CAP 患者体内链球菌种群的富集持续到随访期,而韦荣球菌、二氧化碳噬纤维菌和罗氏菌的丰度在 4 个月的随访中恢复到与健康对照组相当的水平。
在急性 CAP 期的三个时间点,菌群组成在物种水平上并无差异,表明在整个 CAP 病程中菌群失调状态保持稳定(图2b)。值得注意的是,链球菌是大多数 CAP 患者中的优势菌,其高丰度在整个 CAP 期间甚至到随访期均持续存在(图2c),T1、T2、T3 和随访期的中位百分比分别为 8.9%、9.8%、10.0%和 19.0%。另外两个在三个急性 CAP 时间点高度富集的主要分类群,韦荣球菌和普雷沃氏菌,随着患者在随访期间的康复而丰富度下降,导致微生物群组成与急性期不同(图2d)。

图2. CAP 患者痰液微生物群在物种水平上的动态变化。
(a) 与健康对照者相比,CAP 患者的细菌种类显著富集。(b) PCoA显示在急性 CAP 期的三个时间点微生物群组成没有差异。(c) 在三个急性 CAP 期(T1、T2 和 T3)和随访中,每个样本中前 10 种细菌种类的相对丰度。(d) PCoA比较急性 CAP 期和随访期之间的微生物群组成。
03
CAP 患者中致病微生物群基因模块富集
宏基因组功能注释鉴定出 3968 个微生物 KO,其中 287 个在 CAP 患者中比健康对照组更丰富,961 个更少丰富。在最显著改变的基因中,mcsA 和 mcsB 均与微生物 DNA 修复和应激反应有关,在 CAP 患者中丰度增加最多。这种丰度升高表明 CAP 患者呼吸道中的细菌可能正承受着巨大的压力,这可能是由于宿主的免疫反应或抗生素治疗所致。此外,rfbP 是 CAP 患者中丰度显著增加的前 10 个基因之一。该基因参与 O 抗原生物合成,O 抗原是细菌外膜的关键组成部分,在免疫逃避中发挥作用,使病原体能够存活并引起感染。在健康对照组中,与遗传迁移(insB)和营养代谢(fucR、gltI、aatJ)相关的基因更为丰富。这表明呼吸道微生物群处于共生状态,维持着平衡的微生物群落,而不会引发致病反应。
为了便于解释 CAP 相关的微生物功能,他们通过 KO 富集分析将差异富集的 KO 聚合到 KEGG 通路中。CAP 患者中富集的大多数通路与必需氨基酸的生物合成和能量代谢有关(图3a)。值得注意的是,磷壁酸生物合成和肽聚糖生物合成途径在 CAP 相关微生物群中也高度富集。这些途径对于构建和维持细菌细胞壁至关重要,尤其是在革兰氏阳性菌中。此外,参与 O 抗原核苷酸糖生物合成的途径(O 抗原核苷酸糖是细菌外膜的关键成分,有助于免疫逃避)在 CAP 队列中显著富集,这些途径的富集持续存在于整个 CAP 急性期。他们通过重新分析了微生物功能谱。在通过 HUMAnN2 分析富集的 33 条通路中,有 26 条也根据 HUMAnN3 进行了显著富集。值得注意的是,在 CAP 患者中富集的所有三种链球菌相关通路均在两个版本中一致地识别,这支持了结果的可靠性和可重复性。
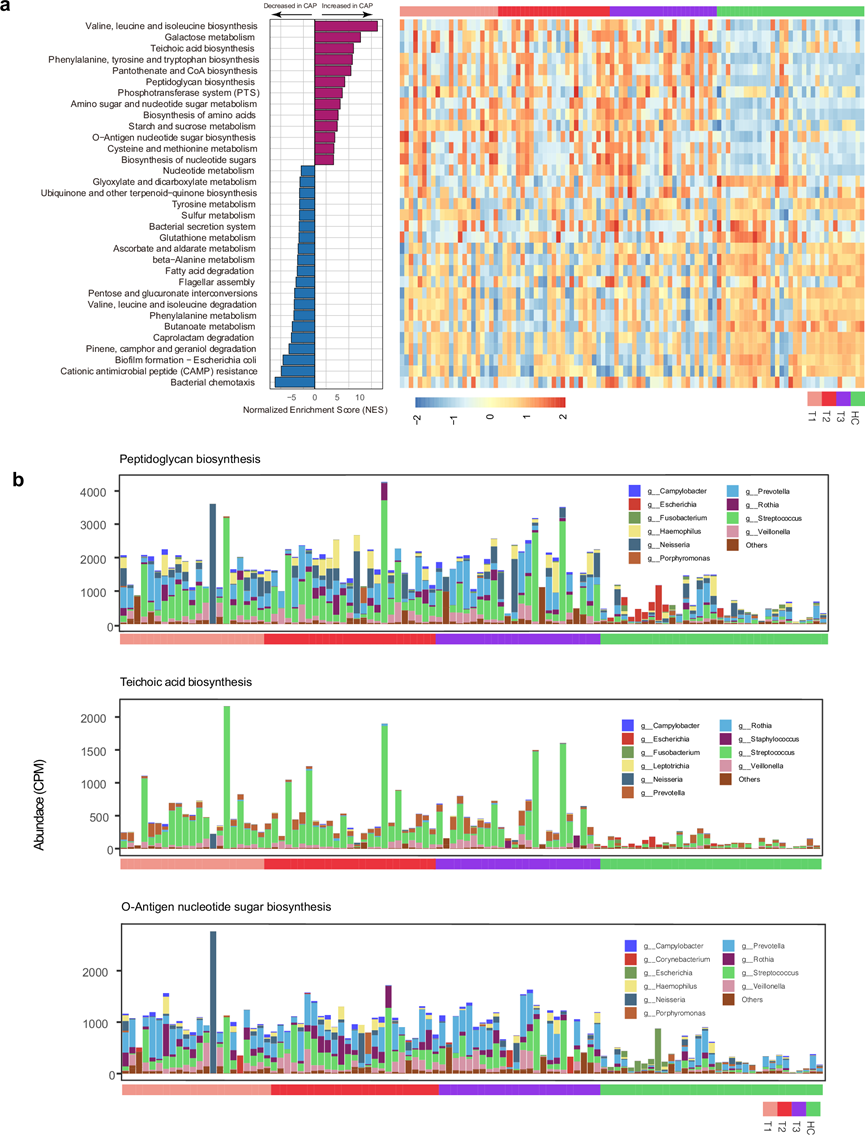
图3. CAP患者中致病菌基因模块富集。
(a) CAP患者和健康对照中显著富集的KEGG通路。(b) 细菌种类分布及其对与细胞壁增强和宿主反应调控相关的三条通路的贡献。
04
CAP患者链球菌菌株水平呼吸道肠道相关性
除了呼吸道菌群,肠道菌群也受到 CAP 的影响。与健康对照组相比,CAP 患者的肠道菌群也表现出明显的变化(图4a),其特点是有益微生物如Faecalibacterium prausnitzii、Bifidobacterium longum和Roseburia hominis的大量减少,这四种菌群是 CAP 患者中丰度降低最多的(图4b)。值得注意的是,他们观察到 CAP 呼吸道菌群中富集的某些细菌,如S. mitis和Rothia mucilaginosa,在肠道中的丰度也有所增加,这表明这些细菌可能存在呼吸道-肠道传播(图4c)。他们发现呼吸道菌群中消耗的微生物在 CAP 患者肠道菌群中的丰度并没有降低。由于S. mitis在CAP呼吸道中相对丰度较高,进一步对呼吸道和肠道微生物中的S. mitis进行了菌株水平分析。在10份痰液样本和3份粪便样本中,这些样本覆盖率足以进行菌株水平分析,在同一个体入院后第1天(A3)和第3天(Q10)的两个微环境内均鉴定出高度相似的菌株,提示可能存在呼吸道-肠道迁移事件(图4 d)。
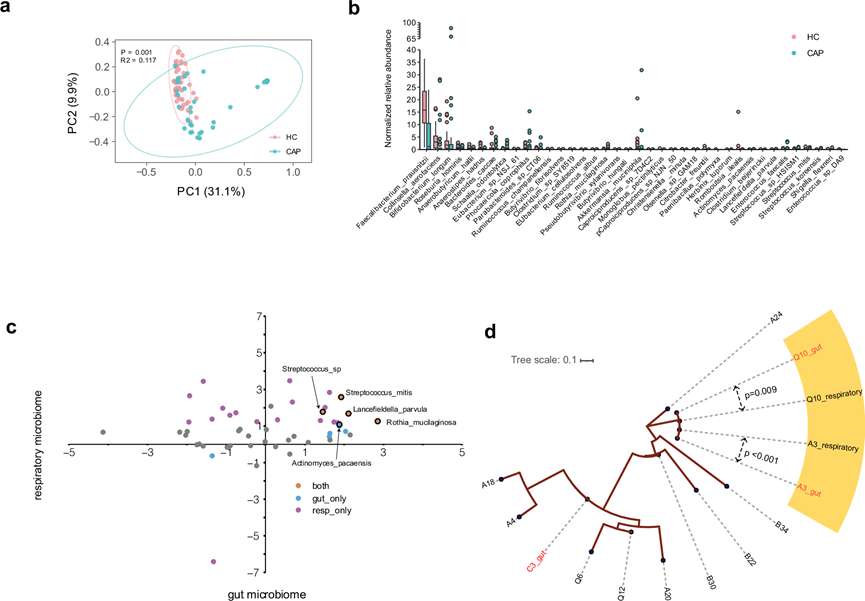
图4. CAP患者富含的呼吸道微生物与肠道菌群的关联。
(a) PCoA图显示了CAP患者与健康对照组之间肠道菌群组成的明显差异。(b) CAP患者与健康对照组之间38个差异丰度物种的箱线图。(c) CAP患者与健康对照组之间呼吸道和肠道菌群的差异丰度物种分析。(d)菌株水平分析,构建了Streptococcus mitis的系统发育树。
05
CAP 患者的呼吸道微生物组-宿主相互作用
为了探索社区获得性肺炎 (CAP) 患者呼吸道菌群与宿主反应之间的相互作用,他们进行了加权基因网络分析 (WGCNA),以识别共表达基因的模块及其与微生物的关联。他们鉴定出三对具有潜在关联的基因模块和微生物聚类,具体为黄绿色模块与微生物聚类 3,棕褐色模块与微生物聚类 4,以及鲑鱼色模块与微生物聚类 5。为了识别潜在的细菌-基因相互作用途径,他们进行了 Spearman 相关性分析,以根据每个重要的基因-模块-微生物-聚类中的宿主基因表达水平和微生物丰度来检测单个基因与微生物物种之间的关联。
黄绿色模块中的基因与聚类 3 中的细菌没有建立显著关联,该聚类包括奈瑟氏菌属的 6 个物种。微生物聚类 5 包含 8 种细菌,其中两种密切相关的链球菌S. oralis (SOR) 和S. mitis与浅橙色模块中的 6 个基因建立了直接关系。基因富集分析表明,该模块中的基因主要参与激活先天免疫反应、病毒过程和细胞因子反应,这表明这两种链球菌可能在病毒感染期间调节宿主免疫反应方面发挥作用(图5a-b)。同样,包含 150 种微生物的微生物聚类 4 显示出Schaalia cardiffensis与棕褐色模块中的 5 个基因之间的显著关联,该模块包括 66 个基因,并富集了与淋巴细胞活化和 T 细胞活化相关的途径。
鉴于该 CAP 队列中超过一半为 COVID-19 患者,他们另外招募了 22 名感染甲型流感的 CAP 患者,以验证在其他感染情况下 SOR 与宿主免疫反应之间的关联。正如预期的那样,确定了与 SOR 表现出最显著关联(最低p值和最高相关系数)的青绿色模型(图5c)。随后对青绿色模块进行基因富集分析,发现在前 20 条富集通路中,有 6 条与免疫激活和调节相关的通路(图5d)。值得注意的是,专门参与免疫反应激活、病毒过程和免疫反应调节/激活信号传导的 4 条通路在原始 CAP 队列和 FluA 队列中均一致富集,突出了 SOR 在各种感染环境中潜在的普遍功能作用。
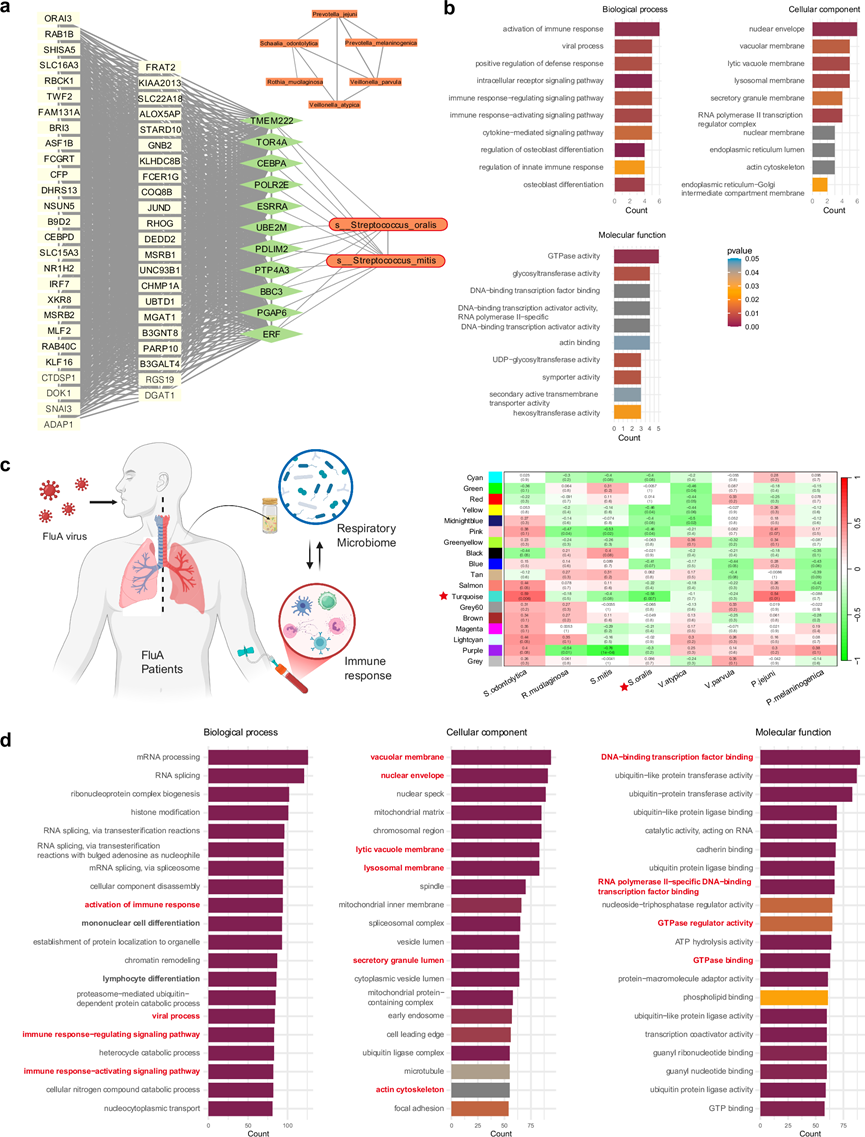
图5. 通过 WGCNA 和 Spearman 相关性分析识别 CAP 患者的基因-微生物相互作用。
(a) 网络可视化显示微生物聚类 5 中的S. oralis和S. mitis与浅橙色模块中基因之间的显著关联。(b) 与S. oralis和S. mitis相关的模块中基因的生物过程、细胞成分和分子功能的基因富集分析。(c) 在FluA 队列中验证了微生物聚类 5 中的细菌与宿主反应之间的关联。(d)基因集富集分析。
06
S. orals通过快速激活先天免疫反应来预防流感病毒感染
微生物组-转录组整合分析鉴定出三种与宿主免疫反应呈正相关的细菌。鉴于S. cardiffensis在 CAP 患者和健康对照者中均表现出较低丰度,他们将注意力集中在两种链球菌及其在调节宿主免疫反应中的作用上。由于关于 SOR 的保护作用及其与 CAP 和流感人群中的免疫激活途径一致关联的数据有限,因此选择 SOR 进行功能验证。从一名 CAP 患者中成功分离出一株 SOR 临床菌株,并在甲型流感病毒 (IAV)感染前通过鼻内途径接种小鼠四次(图6a)。预先接种 SOR 可显著减少 IAV 引起的体重减轻,其功效可与鼠李糖乳杆菌 GG (LGG) 相当(图6b)。值得注意的是,SOR 将感染小鼠的存活率从 30% 提高到 70%,略高于 LGG 启动后观察到的 60% 的存活率,尽管差异无统计学意义。此外,感染后 48 小时肺中的感染性病毒颗粒数量也低于未经 SOR 启动的小鼠(图6c)。SOR 预处理还导致感染后 6 天 BALF 中炎症标志物 IL-6 和 TNF-α 的水平降低(图6d)。感染后第 6 天收获的小鼠肺的病理学分析显示,SOR 预处理减少了炎症细胞浸润和肺损伤(图6e)。此外,SOR 减轻了肺泡毛细血管屏障损伤,以 BALF 中较低的总蛋白浓度来衡量,表明肺泡毛细血管膜的通透性改善(图6d)。为了探究SOR对抗IAV感染的潜在机制,他们对IAV感染前接受SOR预处理或未接受SOR预处理的小鼠在感染后第2天和第6天的肺组织进行了转录组分析。与未接受SOR处理的小鼠相比,SOR预处理组在感染后第2天显著增加了多种免疫调节基因的表达,包括IL17F、LY6I和C1RB,从而增强了参与细菌感染、病毒蛋白与细胞因子相互作用、细胞因子和趋化因子信号传导以及补体反应的通路的激活(图6f)。这些上调的通路大多数在宿主防御呼吸道感染中发挥关键作用,它们在 IAV 感染早期的高度激活可抑制病毒传播并改善小鼠的预后。然而,到感染后第 6 天,当小鼠开始恢复时,这些促炎基因在 SOR 治疗组和未治疗组之间不再有差异表达(图6g)。同样,在第 2 天高度激活的促炎通路在第 6 天没有富集。这些发现表明,预先接种 SOR 可促使及时激活先天免疫反应,从而有效限制 IAV 感染,而且重要的是,这些通路在恢复期迅速消退,以防止免疫介导的病理。
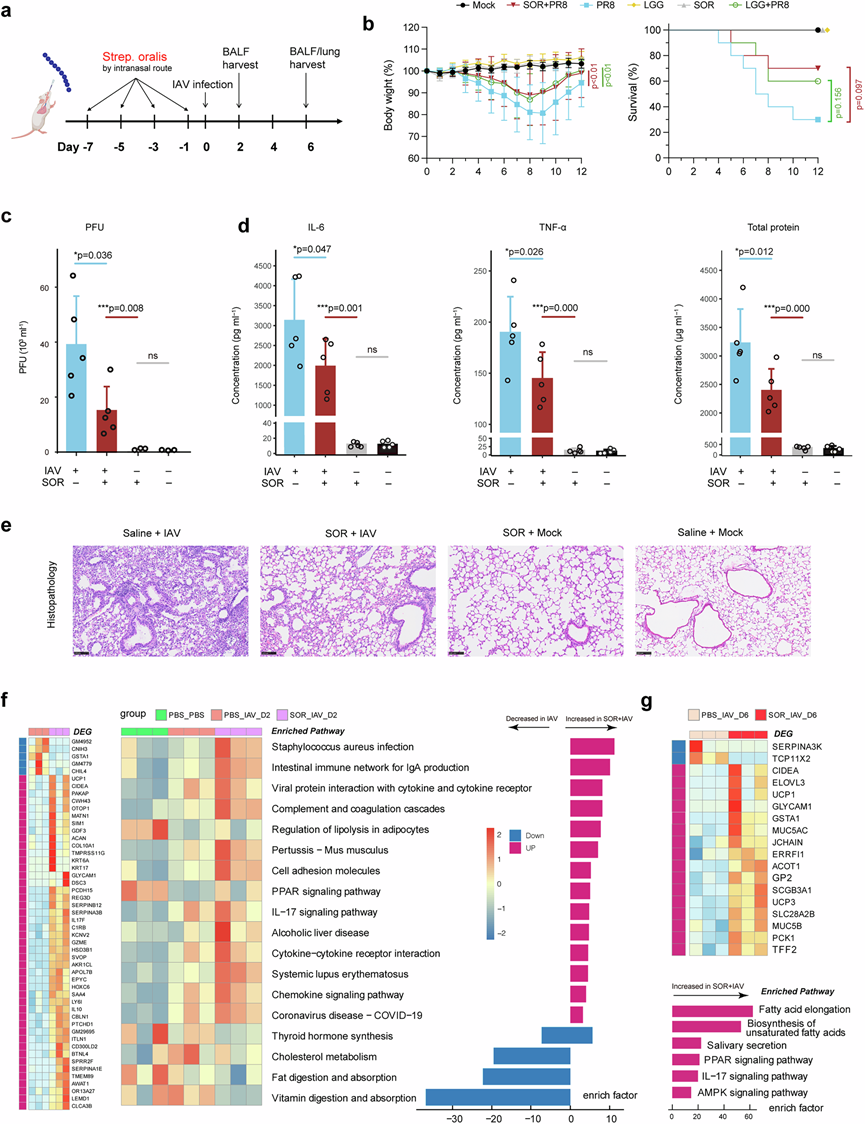
图6. 口腔链球菌 (S. oralis)在小鼠模型中对抗甲型流感病毒 (IAV) 感染的保护作用。
(a) 实验设计示意图。(b) 接种SOR和 LGG 可减轻 IAV 引起的体重减轻并提高小鼠的存活率。(c) 感染后 48 小时,四组肺部病毒载量以斑块形成单位 (PFU) 为单位。(d) 感染后第 6 天小鼠 BALF 中炎症标志物 IL-6 和 TNF-α 的水平以及总蛋白浓度。(e) 用苏木精和伊红染色。(f-g) 差异表达基因和通路分析。
+ + + + + + + + + + +
结 论
本研究使用 38 例 CAP 患者纵向采集的样本,对呼吸道和肠道菌群进行了宏基因组学分析,并进行了血液转录组学分析。CAP 患者在住院早期、中期和晚期均出现痰液菌群紊乱。参与肽聚糖生物合成和免疫逃逸的微生物途径,尤其是链球菌CAP 患者中富集。此外,几种链球菌菌株在 CAP 患者的呼吸道和肠道菌群之间表现出相关性。通过整合宿主反应数据,口腔链球菌(SOR) 与宿主参与感染先天免疫反应的途径有关,并且在新招募的 CAP 队列中重现了这种微生物-宿主相互作用,该队列由 22 名流感感染患者组成。在小鼠模型中验证了宿主-SOR 相互作用,其中 SOR 表现出与成熟的呼吸道益生菌鼠李糖乳杆菌 GG相当的抗流感病毒感染保护作用。在小鼠中预先吸入 SOR 可显着减轻体重减轻,减少肺部炎症,并降低流感病毒攻击后的病毒载量。宿主反应分析表明,SOR 启动在感染早期激活了更强大的先天免疫反应,并且随着宿主开始恢复,这种反应会及时消退。这些发现表明呼吸道共生菌通过诱导及时的先天免疫反应来防止 CAP 进展,从而发挥免疫保护作用。
+ + + + +



 English
English


